- a Sehas 3-D szerkezeti jellemzői
- az I. osztályba tartozó Alszerkezeti elemek (SSE)
- az UDP-szubsztrátok Kötőhelyei átfedik egymást
- A Lys-139 nélkülözhető a sehas-ban, és szerepet játszik a szubsztrátkötésben
- az SSE5 kötődik a polimerhez és befolyásolja a HA termelést
- a Gln-248 (SSE7) kritikus, elfogadható szerepet játszik a konformációs átmenetben
- SSEs kiállítás koordinált mozgás
- redukáló végpolimer megnyúlás a SeHAS-ban, egy elfogadható háromlépcsős mechanizmus
- Glikoziltranszferáz reakció valószínűleg több lépésben fordul elő
- javasolt háromlépcsős glikoziltranszferáz reakció
a Sehas 3-D szerkezeti jellemzői
a Sehas-szekvencia szerkezeti modelljét a RaptorX webserver26 segítségével állítottuk elő. A modellt cellulóz-szintáz sablonnal (PDB: 4P00) kaptuk.A sablon enzim nagy funkcionális hasonlóságot mutat, és alacsony szekvenciahasonlóságot mutat (~15%) a SeHAS25-Tel. A sablonnal való gyenge szekvenciahasonlóság ellenére a kapott modell kiváló minőségű, amint azt a globális (P-érték: 10-8) és az abszolút (GDT-pontszám: 52) minőségmérések26 jelzik. A szerkezeti modell sztereokémiai minőségértékelése azt mutatja, hogy a maradékok 98,5% – A a Ramachandran-parcella megengedett/részben megengedett régiójában található.
az 1. ábra a sehas szerkezeti modelljét mutatja. A HAS szerkezeti modellje azt mutatja, hogy az Egylánc három részre hajlik: (i) funkcionális glikozil-transzferáz domén, (ii) négy transzmembrán hélix (TM1-TM4) és (iii) három amfipatikus hélix (AP1-AP3). A glikozil-transzferáz domén elfogadja a GT-A-t, amelyet vegyes 7-szálú adapterek alkotnak, amelyeket körülvesznek. A transzmembrán hélixek (TM1-TM4) négy hélixköteget alkotnak, és pórusokat hoznak létre a polimer transzlokációhoz. 11 a SeHAS C-terminális maradékai az előrejelzések szerint rendezetlenek, és az ábrán nem láthatók. 1. A sehas oligomer jellegét még vizsgálják. 2018-ig a SeHAS-ra jellemző volt, hogy monomer formájában9 működik. A legújabb jelentések szerint a SeHAS enzim homodimer27-ként működik. A jelen munka hatóköre a protomer jellemzőinek értékelésére korlátozódik.

a Sehas szerkezeti modellje és jellemzői. SSE: Alszerkezeti elem, AP: Amfipatikus hélix, TM: transz-membrán hélix.
a Sehas 3-D szerkezeti modellje összhangban van a Streptococcus pyogenes korábban meghatározott topológiájával, amely fúziós, címkézési és proteáz-hozzáférhetőségi kísérletek12,16,19 alkalmazásával származik, enyhe különbséggel az amfipatikus hélixek számában. Három amfipatikus hélix jelenlétét javasoljuk a korábban a cellulózszintáz szerkezettel végzett összehasonlító értékelés alapján korábban jelentett két amfipatikus hélix helyett. Az amfipatikus hélix AP2-nek megfelelő SeHAS-maradványokat nem vizsgálták kifejezetten sejtes elhelyezkedésük16. Amint azt a kézirat később tárgyalja, ez a hélix funkcionális jelentőségű maradványokat tartalmaz.
a szerkezeti modell magyarázza az n-etil-maleimid (NEM) gátlás eredményeit a Sehas-Ban19. A NEM reagál a tiolcsoportokkal, ezért a ciszteinmaradványok fehérjékben betöltött szerepének vizsgálatára szolgál. A SeHAS-nak négy Cys-maradványa van: Cys-226, Cys-262, Cys-281 és Cys-367. Az első három ciszteinmaradék a citoszolban helyezkedik el, ezért a nem számára hozzáférhetőek, ami gátláshoz vezet. A Cys-367 azonban a transzmembrán hélixben található, és nem érhető el. Ezért ezen szermaradék esetében nem jelentettek gátlást. Szubsztrát jelenlétében kimutatták, hogy a NEM csak a Cys-281-hez kötődik. Szerkezeti vizsgálataink (amelyeket később ismertetünk) azt mutatják, hogy a Cys-226 és a Cys-262 az UDP-szubsztrát kötőhelyének közvetlen közelében helyezkednek el, és a szubsztrát jelenléte így megakadályozza a NEM hozzáférését ezekhez a maradványokhoz. A Cys-281 az UDP-kötőhelytől távol helyezkedik el, és a szubsztrát jelenléte nem gátolja a nem-gátlást.
az I. osztályba tartozó Alszerkezeti elemek (SSE)
az I. osztályba tartozó funkcionális gépekről kevés információ áll rendelkezésre. 3D szerkezet hiányában a kísérletileg vizsgált helyek funkcionális szerepe nem ismert. Ezért, hogy megértsük a sehas funkcionális komponenseit és azok relatív elrendezését a 3D-ben, azonosítjuk a rövid, összefüggő régiókat evolúciósan konzervált szekvenciajellemzőkkel, amelyeket szubstrukturális elemeknek (SSE) nevezünk. Összehasonlítottuk 81 Az I. osztályba a módszerek részben kidolgozott szigorú kiválasztási kritériumok alapján kapott szekvenciák tartoznak. Az I. osztályba tartozó enzimek különböznek a transzmembrán hélixek számában. Strukturális információk hiányában az összehangolás ebben a régióban rossz minőségű. Ezért a szekvenciák összehasonlítása a citoszolos régióra korlátozódik, hogy elkerüljük a kétértelmű maradék-maradék megfeleltetésű helyeket. A HAS I. osztályú szekvenciák összehangolása kiegészítő ábra. S1, létrehozott Jalview. A megőrzési pontszámot minden maradék-maradék megfelelésre kiszámítják a SeHAS-szekvencia tekintetében. Egy összefüggő szakasz, amelynek átlagos pontszáma >=70, és legalább 2 helyszín > =80, szubstrukturális elemként (SSE) van meghatározva. E kritériumok alapján azonosítunk 9 SSE1-SSE9 címkével ellátott alszerkezeti elemet, amelyek potenciális szerkezeti / funkcionális jelentőséggel bírnak az MTA-ban (ábra. 2). A legtöbb SSEs másodlagos szerkezete hurkokra térképez, kivéve az SSE5, SSE8 és SSE9-et, amelyek a hélixekben fordulnak elő. Ezeket az elemeket az ábra is megjelöli. 1. Az 1. táblázat összefoglalja a szekvencia részleteit, valamint az SSE strukturális és funkcionális szerepét.

a telek természetvédelmi pontszám tekintetében SeHAS sorszám. SSE jelzett tetején. A szekvencia másodlagos szerkezeti vetülete alul van feltüntetve. A szálakat nyilakként, a spirálokat pedig téglalapokként jelölik. A kitöltött téglalapok megfelelnek az amfipatikus hélixeknek. Lásd a szöveget a részletekért.
vizsgálati jelentéseink konzerválták az SSES-t: SSE5 és SSE7 specifikus az MTA-ra. Az eddig vizsgált mutációk a Tyr-74, Asp-159, Ser-218, Cys-226 maradékoknak felelnek meg. A Leu-230, Tyr-233, Arg-234, Asp-259, Asp-260, Arg-261, Leu-263, Cys-281, Gln-295, Gln-296, Asn-297, Arg-298, Trp-299, Arg-406, Arg-413 kimutatták, hogy befolyásolják a tevékenységet. A Lys-48, Glu-327, Lys-414, Lys-415 maradékoknak megfelelő mutációk befolyásolják a HA polimer18,19,20,21,23 reakciósebességét és/vagy molekulatömegét. Ezeknek a mutációs helyeknek a többsége SSE1-4, 6, 8 és 9 (1.táblázat).Más oldalak nem konzervált jellemzője I. osztályú család. Bi et al. (2015) elemezte a különböző processzív glikozil-transzferázokat, és megvitatta a glikozil-transzferáz doménben található három változó távolságra elhelyezkedő Asp-szermaradék jelenlétét, amelyek létfontosságúak25. Ide tartoznak az SSE1-ből származó ASP nukleotidkötésben, az SSE2 ASP-je a fémhez való kötődésben, Asp az SSE8-ban, valószínűleg bázisként. Ezenkívül az SSE9 maradékai esetében valószínű szerepet javasolnak a polimerkötésben. Weigel (2015) nyolc ASP/Glu-t javasolt, amelyek tri-peptideket tartalmaznak, mint potenciális régiók, amelyek részt vesznek az UDP-cukor kötésében12. Az SSE szerepének tisztázása és az UDP-cukrokhoz kötődő régiók azonosítása érdekében dokkolási szimulációkat végeztünk.
a HAS enzimnek várhatóan legalább két kötőhelye van, az egyik az UDP-cukor szubsztrátokhoz, a másik pedig a polimer cukorhoz glikozidos kötés képződésének katalizálásához12. Az enzimszerkezet kötőhelyeinek azonosítása érdekében UDP-cukor szubsztrátok: UDP-N-acetil-glükózamin és UDP-glükuronsav dokkoló vizsgálatát végeztük. Az UDP-szubsztrátok kötési régióját egy rácson keresztül értékeljük, amelynek középpontja a módszerekben meghatározott glikozil-transzferáz doménben van.
az UDP-szubsztrátok Kötőhelyei átfedik egymást
az UDP-N-acetil-glükózamin és az UDP-glükuronsav dokkolási szimulációit külön végzik el. Alacsony energiájú konformereket (jobb, mint 5 kcal/mol) választanak ki. A 3A. ábra az energetikailag kedvező konformerekkel rendelkező különböző helyszínek érintkezési gyakoriságát mutatja a különböző szimulációs futások során. A két szubsztrát bármelyikének legalább 10% – os gyakoriságú poláris maradékai láthatók. Az ábra figyelemre méltó megfigyelése az, hogy a két cukor szubsztrát kötőhelyei átfedik egymást.

(a) az UDP-N acetil-glükózamin (UDP – GlcNAc) és az UDP-D glükuronsav (UDP-GlcA) energetikailag kedvező konformereinek Ligandummal érintkező szermaradékainak gyakorisága. A frekvenciát az X tengelyen, a helyeket pedig az Y tengelyen ábrázoljuk. B) az SSE1–4, SSE8 és SSE9 szerepe az UDP-cukor szubsztrátkötésben. C) az SSE6 szerepe a ligandumkötésben. D) az SSEs szerepe a polimer kötésben. E) az SSE7 szerepe. (I) SSE7 hurok hialuronán-szintázban, (ii) ekvivalens hurok cellulóz-szintázban, (iii) ekvivalens hurok nem processzív glikozil-transzferázban. (F) a minimalizált energia szerkezete UDP-N-acetil-glükózamint és glükuronsav és N-acetil-glükózamin moeities diszacharidját mutatja.
az érintkező maradványok szerepét az energetikailag legkedvezőbb biológiailag releváns konformerrel való kötés vizsgálatával értékeltük. A konformer kiválasztását az UDP nukleotidgyűrűjének közelsége vezérli az evolúciós konzervált SSE1-hez, amelyről ismert, hogy részt vesz a nukleotidkötésben. A kötőzsebben lévő kiválasztott konformerek az ábrán láthatók. 3B. az SSE1-SSE4, SSE6, SSE8 és SSE9 részt vesz a szubsztrátkötésben (ábra. 3B). Az SSE1, SSE2 és SSE4 nagymértékben stabilizálja a szubsztrátok uridin részét, míg az SSE3, SSE8 és SSE9 kölcsönhatásba lép a cukorgyűrűvel. A szubsztrát UDP-gyűrűjének enzimmel való kezdeti kötődését megkönnyítheti (i) az SSE2 konzervált Asp-103 oldallánca (kék, ábra. 3B) hidrogénkötéseken keresztül a nukleotid poláris csoportjaival és (ii) a Tyr-74 aromás gyűrűjével (zöld, ábra. 3B) az SSE1-től az UDP uridin-gyűrűjével való kölcsönhatásokon keresztül. A Glu-76 oldallánca (zöld, ábra. 3B) az SSE1-ből hidrogénkötéseket képez az UDP ribózcukor poláris csoportjaival. Az SSE4-ből származó ASP-161 maradék stabilizálja a ribózgyűrű OH csoportját, míg az Asp-159 stabilizálja a fémiont. Az SSE9-ből származó Gln-295 és Arg-298 (kék) kölcsönhatásba léphet és stabilizálhatja az UDP nukleotid pirofoszfátcsoportját. A Trp-299 NE atomja H-kötési távolságban van a cukor szubsztrátumtól, és valószínűleg segít a szubsztrátum orientálásában. Az Asp-260 topológiailag egyenértékű a cellulóz-szintáz katalitikus bázisával25. Az SSE8 ASP-260-at tart. Az ASP-259 és az Arg-261 a cukorgyűrű poláris csoportjaival kölcsönhatásba lép (zöld). Az Arg-140 maradékot a Lys-139 mellett részben konzerválják, és a Sehas homológokban csak Lys-sel helyettesítik. Ez a maradék az SSE8 (zöld) helix holding N-terminális végének közvetlen közelében található. Ez a vég negatív töltésű Asp-maradványokat tartalmaz, amelyeket az Arg-140 semlegesíthet.
Sse6 maradékai (ábra. 3C) hozzon létre egy állványt a ligandumok támogatására a kötési helyen. A hurok stratégiailag elhelyezett formák alapja kötési zseb. A hurok is ül közel katalitikus bázis (SSE8) és a kötött polimer cukor (később tárgyaljuk). Amint azt fentebb tárgyaltuk, az N-etlymaleimid alkalmazásával végzett kísérletek ennek az elemnek a konzervált Cys-226-ját az UDP-cukorkötő hely19 közelében helyezik el. Ez valószínűleg részt vesz a mikrokörnyezet pKa fenntartásában az aktív helyen. Bár nem elengedhetetlen az aktivitáshoz, ennek a maradéknak az Ala-ra történő mutációja bizonyítottan befolyásolja az aktivitást a Sehas-ban19, 28. A ser-227 oldallánca valószínűleg részt vesz a hurok konformációjának stabilizálásában a fő lánccal való kölcsönhatások révén. Gly-228 és Pro-229 biztosítja a szükséges rugalmasságot és merevséget a fő lánc konformáció, ill. 3C).
A Lys-139 nélkülözhető a sehas-ban, és szerepet játszik a szubsztrátkötésben
a dokkolási értékelések a Lys-139 szerepét sugallják a ligandumkötésben. Korábbi tanulmányok beszámoltak ennek a maradéknak a szabályozó szerepéről az MTA emlős formáiban. Egérben az Arg mutációja teljes aktivitásvesztést eredményez24. A sehas-ban végzett mutációs vizsgálatok hiányában szerepének további tisztázása érdekében Lys-139 mutációs vizsgálatokat végeztünk. A kísérleti beállítás és a vizsgálat részleteit a módszerek című részben ismertetjük. A vizsgálathoz használt kísérleti eredmények és pMBAD vektor térkép az ábrán látható. 4A, B, ill. A Lys-139-et Arg-re (K139R) mutáltuk azzal a céllal, hogy megőrizzük a töltést ebben a helyzetben. A mutáció nem vezetett az aktivitás teljes elvesztéséhez, de hatással volt. Csak 34% – os aktivitás (HA termelés) maradt meg a kontrollhoz képest, amely megismétli ennek a maradéknak a jelentős funkcionális szerepét (ábra. 4A). A maradék és a szubsztrát közötti töltésalapú kölcsönhatás további vizsgálatához pozitív töltésű Lys-139-et negatív töltésű Asp-re (K139D) mutáltunk. A negatív töltés a helyszínen 82% – os aktivitás (HA termelés) megtartásához vezet a kontrollhoz képest. Ez az elemzés arra utal, hogy ennek a maradéknak szerepe van a szubsztrát poláris csoportjainak stabilizálásában. A helyettesítések kiválasztása tovább szemlélteti, hogy mind a pozitív, mind a negatív töltésű csoportok elhelyezésre kerülnek a helyszínen. Vizsgálataink azt mutatják, hogy ez a maradék közvetlenül befolyásolja a sehas szintáz aktivitását. Ezen a helyen a mutációk jelentős mértékben károsítják a szintáz funkciót.

mutációs vizsgálatok a SeHAS-on. A) Az ebben a vizsgálatban végzett sehas mutánsok relatív aktivitása. A kísérleteket három példányban végeztük, és a HA-titer standard hibája a 0,01-0,05 közötti tartományban volt. (B) pMBAD vektor konstrukció. hasa és HASB gének Streptococcus equi subsp. a zooepidemicust egymás után klónozták. Mutációs vizsgálatokhoz a hasA wildtype-t megfelelő mutáns(ok) ra cserélték.
az SSE5 kötődik a polimerhez és befolyásolja a HA termelést
az AMFIPATIKUS hélixek által létrehozott UDP-szubsztrát kötési régió feletti üreget a polimer egység kötődésére értékeljük. A polimerkötési vizsgálat a glikozidos kötésképződésben részt vevő terminális diszacharidra korlátozódik. A dokkolási vizsgálatokat ha diszacharid egységgel végezték, amely egy glikoziltranszferáz doménben lévő, 6-4 év közötti N-acetil-glükózaminból és D-Glükuronsavból állt. Energetikailag kedvező konformereket választottak ki. A 3D ábra egy HA diszacharid egységet mutat, amely a kötőzseb közelében van dokkolva. Az SSE5, az SSE8 és az SSE9 részt vesz a kötésben (ábra. 3D). Az SSE8-ból származó ASP-260 maradék H-kötési távolságban van a polimer Oh végcsoportjától, és szaggatott vonallal van jelölve az ábrán. Az SSE8 3D. Arg-261 a polimerhez közel helyezkedik el, és kölcsönhatásba léphet a cukor poláris OH csoportjaival. Az SSE9-ből származó Trp-299 maradék CH-6 kölcsönhatást képez a végcukorral.
legjobb tudásunk szerint ez az első jelentés, amely feltételezi az SSE5 maradványainak funkcionális bevonását. Az SSE5-ben a polimerhez való kötődésben kulcsmaradékok az Arg-205, Tyr-206, Phe-210 és Arg-214. Az Arg-205 a dokkolt diszacharid közvetlen közelében található,és részt vesz a negatív töltésű poláris cukorcsoportokkal való kölcsönhatásban. A sehas homológokban a Tyr-206 vagy a fenilalanin stabilizálja az Arg-205 maradékot kation-Davis kölcsönhatások révén. Az Arg-214 vagy Lys homológ szekvenciákban közel van a polimerhez, és közel van a részlegesen konzervált Phe-210-hez, amellyel kation-MHz kölcsönhatásokat képez. Az SSE5-ből származó maradékok mutációjának következménye nem ismert. Itt a Tyr-206 és az Arg-214 mutációjának következményeit vizsgáljuk a helyszínen irányított mutagenezis révén. Kísérleti eredményeink azt mutatják, hogy az aromás tirozin alaninná (Y206A) történő mutálásával a kation-Anavar kölcsönhatások megzavarása 99% – os HAS-aktivitás veszteséget eredményez (ha termelés) (ábra. 4A). Ennek a kölcsönhatásnak a elvesztése közvetett módon befolyásolhatta a polimer kötődését a szomszédos Arg-205-en keresztül. Hasonlóképpen, a bázikus argininmaradék 214-es mutációja alaninra (R214A) a funkció teljes elvesztéséhez vezet (ábra. 4A). Érdekes, bevezetése negatív töltés (R214E)vezet 93% funkcióvesztés (ábra. 4A). Ezek az eredmények megismétlik a nettó pozitív töltés szükségességét ezen a helyen a polimer kötésének és transzlokációjának megkönnyítése érdekében. Ezek a mutációk a polimerkötés/transzlokáció és a glikoziltranszferáz aktivitás kölcsönös függőségét jelzik.
továbbá a két ligandummal (UDP-cukor és diszacharid) komplexált enzim energiáját AMBER erőterek alkalmazásával minimalizálták. A 3F.ábra az UDP-N-acetil-glükózaminhoz és diszacharidhoz kötődő enzimet mutatja, amelyet a polimer végén glükuronsavval összekapcsolt glükuronsav és N-acetil-glükózamin képez. A minimalizálási protokoll részleteit a módszerek ismertetik.
a Gln-248 (SSE7) kritikus, elfogadható szerepet játszik a konformációs átmenetben
a Gln-248 konzervált maradék az SSE7-ben, hosszú hurok távol a kötési helytől. Az ekvivalens hurok mind a processzív, mind a nem processzív homológokban szekvenciálisan eltérő, és különböző konformációkat mutat a szubsztráthoz kötött és nem kötött enzimformákban (ábra. 3E (ii)) 29,30,31 és Fig. 3e iii. bekezdés 6-4. bekezdés galaktoziltranszferáz, EKT. kód: 2fyd és 2fy7) 32. A sehas-ban lévő hurok valószínűleg megkönnyíti az SSE8 pozícionálását a katalízishez. A Gln-248 maradék távol van a kötőzsebtől; ennek a maradéknak a pontos szerepét ezen in-silico vizsgálatok alapján nem lehetett megjósolni. A házon belüli mutációs vizsgálatok azt mutatják, hogy ez a maradék fontos. A maradék Ala-val történő helyettesítése a HA-termelés majdnem teljes elvesztését eredményezi (ábra. 4A).Ennek a maradéknak a szerepét tovább vizsgáljuk durva szemcsés dinamikus vizsgálatokkal, amelyeket egy későbbi szakaszban tárgyalunk.
SSEs kiállítás koordinált mozgás
a jelenlegi paradigma szerkezet-kódol-dinamika-kódol-funkció33,34,35. Egyre inkább felismerték, hogy az atomok véletlenszerű ingadozása natív állapotukban eltitkolja az összehangolt mozgást, amely hajlamosítja a fehérjét a funkcionálisan releváns szerkezeti változásokra. Ezeket a mozgásokat alacsony frekvenciájú üzemmódokkal lehet rögzíteni a rugalmas hálózati modellezésben. Ezek a módok ismerten érzéketlenek a szerkezeti és energetikai részletekre. Ezért anizotróp hálózati modellezést (ANM), ENM alapú megközelítést alkalmaztunk a sehas 3-D struktúrája által kódolt dinamika globális képének rögzítésére. A ProDy36-ot ANM számításokhoz használtuk. További részletek a módszerek részben találhatók. A koordinált mozgást az ANM hálózat csomópontjai közötti korrelációs együttható értékeként ábrázoljuk. Az átlagos korrelációs együttható értékeket az első 50 mód alapján számítottuk ki. Az 5a. ábra a sehas korrelációs térképét mutatja. A pozitív korrelációs együttható értékek azt jelzik, hogy az atomok ugyanabba az irányba mozognak. A magas korrelációs együtthatóval rendelkező térbeli proximális szermaradékok klasztere szerkezetileg és funkcionálisan is fontosnak tekinthető. A nagy pozitív értékű maradékpárok szubstrukturális elemeknek felelnek meg. Ezenkívül a maradékpárok közötti korreláció kiterjed a különböző SSE-k régióira is. Az SSE1 – 4 szorosan kölcsönhatásba lépő aldomain (fekete téglalap). Hasonlóképpen, az SSE5-9 koordinált interakciós aldomaint (szürke téglalap) alkot. A két aldomaint rosszul Korrelált régió választja el egymástól. A belső globális mozgások szemléltetik az egyik végén a szubsztrátkötéshez szükséges funkcionális koordinációt SSE1-4 a másik végén pedig polimer kötés (SSE5-9).

a globális dinamika értékelése a SeHAS – ban. A) a SEHA-k átlagos korrelációs együtthatójának értékei a maradékpárok között. A GLN-248 (B) és a Thr-283 (C) más sehas-maradékokkal való átlagos korrelációs együttható értékei.
tovább vizsgáltuk a sehas dinamikáját a GLN-248 maradék tekintetében. Fig. Az 5B. ábra a korrelációs együttható értékeinek eloszlását mutatja a sehas-ban található egyéb maradékanyagokhoz viszonyítva. A Gln-248 nagy pozitív értékeket mutat az SSE8, 9 és SSE3 esetében, amelyek katalitikus és szubsztrátkötő maradványokat tartalmaznak. Az ANM-en keresztül értékelt összehangolt mozgás ezekkel az SSEs-kkel tovább szemlélteti szerepét a funkcionálisan releváns konformációs dinamikában.
az ANM vizsgálatot kiterjesztik a mutáció korrelációs együttható értékekre gyakorolt hatásának értékelésére. Mindegyik mutáns esetében szerkezeti modellt kapunk RaptorX26 alkalmazásával. A mutánsok magas szerkezeti átfedést mutatnak, az átlagos RMSD-vel körülbelül 1 ^ minden atomon a WT fehérje szerkezetéhez viszonyítva. Minden mutáns szerkezetre vonatkozóan kiszámítják a mutáns maradékra vonatkozó korrelációs együttható értékeit, és összehasonlítják a WT-vel. A telkek ábrán látható. S2. A 214-es, 248-as és 283-as lokális mutációk jelentős eltérést mutatnak az SSE régiók értékeiben.
redukáló végpolimer megnyúlás a SeHAS-ban, egy elfogadható háromlépcsős mechanizmus
a glikozil-transzferáz GT-2 család prototípusos tagjaiban, például a cellulóz-szintázban,a polimer bioszintézis a növekvő polimer25, 31 nem redukáló végéből következik be. Ilyen rendszerekben az UDP-szubsztrátok donorként működnek, átadva a cukrot a polimer cukornak, amely akceptorként működik24. A cukrok közötti kontinuitionkötést a CC-UDP prekurzorokból hozzák létre, közvetlen kiszorításos SN2 szubsztitúciós reakcióval. Ebben a reakcióban egy katalitikus bázissal végzett deprotonálási lépés funkcionalizálja az akceptorot24. Ennek az akceptor cukorcsoportnak a nukleofil támadása a donorra egyetlen oxokarbénium-ion-szerű átmeneti állapoton keresztül glikoziltranszfer reakciót eredményez az UDP felszabadulásával a donor cukorból, valamint a sztereokémia nettó inverzióját az anomer szénnél. Ezt a mechanizmust az ábra szemlélteti. 6A. a SeHAS különbözik ettől a prototípustól. Ismeretes, hogy a HA megnyúlik a redukáló végtől12. Ez azt jelenti, hogy (i) UDP szabadul fel a polimer végéből, és nem UDP-szubsztrátok a katalízis során, és (ii) a donor és az akceptorok megfordulása HA-UDP-vel, mint donor és UDP-cukor szubsztrát mint akceptor. A ligandumkötés tájképe és az aktív helyszín architektúrájáról szerzett ismeretek alapján megvitatjuk a ligandumok donorként és akceptorként való részvételét, és javaslatot teszünk a glikozil transzfer katalitikus mechanizmusára a SeHAS-ban (Lásd az ábrát. 6B).
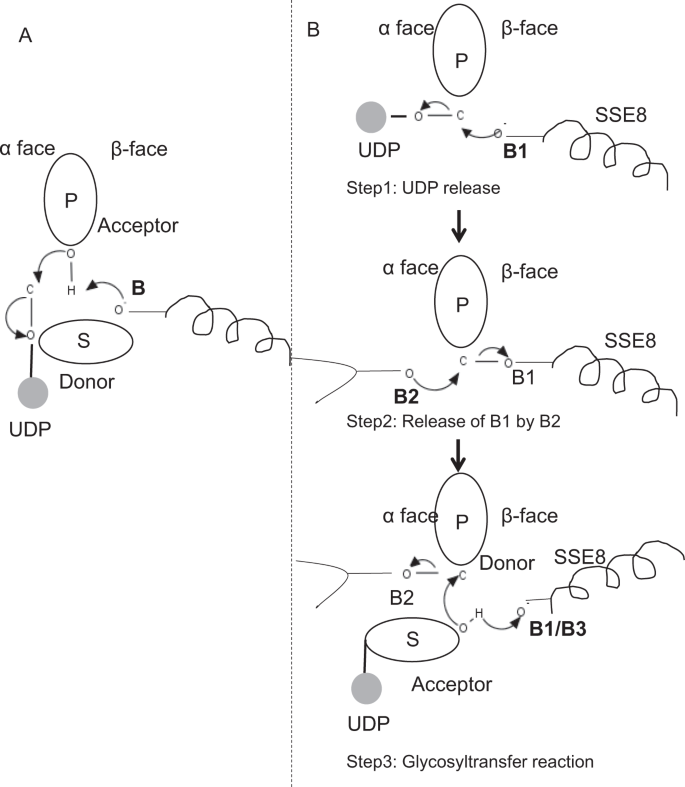
javasolt molekuláris mechanizmus a SeHAS – ban. (A) mechanizmus egy prototípusos glikozil-transzferázban inverziós kémiával. B) javasolt mechanizmus I. osztályú HAS. P: polimer cukor, S: szubsztrát cukor.Az UDP körként van feltüntetve. A B1, B2 és B3 a reakciómechanizmusban részt vevő katalitikus bázisok.
Glikoziltranszferáz reakció valószínűleg több lépésben fordul elő
első lépésként feltártuk az egylépéses glikoziltranszferáz reakció lehetőségét cellulózszintáz-szerű módon. Ha a glikozil-transzferáz reakció egy lépésben megy végbe, akkor az enzimnek egy adott időpontban két UDP-csoportot kell tartania, az egyiket a polimerhez, a másikat a bejövő szubsztráthoz. Az alternatív többlépcsős forgatókönyvben a polimerből származó UDP felszabadul, mielőtt a katalitikus reakció bekövetkezik. Ebben az esetben a sztereokémia nettó inverziójának létrehozásához a reakció páratlan számú lépésben történne SN2 mechanizmus. Annak értékelésére, hogy melyik forgatókönyv valószínűbb, UDP-kötési vizsgálatokat végeztünk UDP-molekulák dokkolásával a glikozil-transzferáz doménben. Az értékelés az UDP és az UDP-szubsztrát kötőhelyek jelentős átfedését jelzi.Az eredményt a kiegészítő részben mutatjuk be. Az UDP egy példaértékű energetikailag kedvező konformációját a szubsztrát – és polimerkötő régiókkal együtt a kiegészítő ábra mutatja. S3. Bár az értékelés a statikus modellen alapul, két nagy, hasonló kémiai természetű molekula elhelyezése a hasonló fiziokémiai környezet követelményeinek közvetlen közelében nem valószínű ennek az enzimnek. Feltételezzük, hogy az SSE9 és a fémion pozitív töltésű maradékaival bélelt átjáró megkönnyítheti az UDP felszabadulását a polimer végéből. A fémion részvétele a glikozil-transzferázban az UDP felszabadulásához szintén jól dokumentált24. Mivel a két UDP-hely nem zárja ki egymást, a többlépcsős reakció második forgatókönyve valószínűbbnek tűnik.
amint az UDP felszabadul a polimerből, a szubsztrát–UDP (akceptor) OH csoportjából származó nukleofil támadás glikozidos kapcsolatot hoz létre. Az inverzió létrehozásához UDP felszabadulást és ezt követő nukleofil támadást kell végrehajtani a polimer cukor két ellentétes oldalán. Javasoljuk a szerepe a három alap katalizátorok az általános reakció, rendszer, amely hazugság az α, illetve β arcok a donor cukor a polimer vége. Ezeket a lépéseket ábra szemlélteti. 6B és az alábbiakban ismertetjük.
javasolt háromlépcsős glikoziltranszferáz reakció
1.lépés: UDP felszabadulás: Asp-260 SSE8 működhet bázisként (B1), és kezdeményezheti az UDP molekula felszabadulását polimerből (donor) a 6-face-ből. Ez a lépés kovalensen kötött glikozil enzim köztiterméket hozna létre, amely a B bázissal szemben a B1 bázissal van árnyékolva. Inverzió létrehozásához a cukor ezen arcának szabadnak kell lennie a bejövő cukor O-H Csoport nukleofil támadására. Ezért egy köztes lépés, a nukleofil támadással a (Z) – től a (Z) – től a (Z) – től a (Z) – tól nukleofil támadás akceptor cukor által.
2. Lépés: A B1 felszabadulása a B2 által; a Thr-283 szerepének feltárása: a B2 bázis a donorcukor felületén a reakcióközpontban nukleofil támadást hajt végre az anomer szén ellen, és felszabadítja a B1-et. Szerkezeti vizsgálataink szerint a GLN-295 és a Thr-283 konzerválódott ezen az oldalon. Az UDP felszabadulása konformációs változásokat eredményezhet, és ezen maradékok egyikét a donorcukor közelébe hozhatja katalízis céljából. A Gln-295 mutációja akár 90% – os aktivitásvesztést eredményez, de a bázis szerepe nem ismert20. Megvizsgáltuk annak lehetőségét, hogy egy konzervált Thr-283 egy hurokban tartózkodjon, hogy második bázisként működjön. A Thr-t hasonló funkcionális OH-csoportot tartalmazó Ser-re, valamint kis alifás oldalláncú Ala-ra mutáltuk. Mind a T283A, mind a T283S mutánsok ~95% – os veszteséget mutatnak a HA termelésben (ábra. 4A). Ez a szermaradék pozitív korrelációt mutat az SSE4 és SSE6 régiókkal, valamint a 186 és a 190 szermaradék közötti térben proximális régióval (ábra. 5C). A 188 maradék, bár nem konzervált, a dokkolt szubsztrátum közelében van (ábra. 3). A Thr-283 nem mutat magas pozitív korrelációt a katalitikus bázist tartó SSE8-mal. Lehetséges, hogy a maradék a katalitikus reakció során támogató bázismaradékként működik, mozgásával összehangolva a térben proximális szubsztrátkötő régióval, amely független az ASP-260 bázistól az SSE8-ban. További kísérletekre lenne szükség a bázis szerepének igazolásához. Összességében a tanulmány még egy funkcionálisan kritikus maradékot emel ki, amely korábban nem ismert.
3.lépés: glikozil-transzferreakció: A B1 felszabadulása után a polimer cukor anomer szén-dioxid-felületének blokkja feloldódik a reakcióhoz. A szubsztrát-UDP ugyanazon az arcon egy harmadik bázissal történő deprotonálása nukleofil csoportot hozna létre. Ezt a lépést a B1 vagy egy másik B3 bázis kezdeményezheti. Az Asp-259 a B1 mellett egy erősen konzervált maradék a szubsztrát-UDP közelében, és B3-ként működhet. A B1 / B3 azonban közelebb van a polimer cukorhoz (donor), amint azt az 1.lépésben tárgyaljuk. A deprotonáció megkezdéséhez a B1-nek az akceptor cukor közelében kell lennie. Ezt az SSE8 konformációs változásaival lehet elérni, az SSE7 támogatásával. A cellulóz-szintázban lévő ekvivalens hélix katalitikus bázist tart, és koordinált konformációs átmeneteken megy keresztül a glikozil-transzferáz reakció és transzlokáció során. Az akceptorcukor nukleofil támadása a donorcukor anomer szénére glikozidos kapcsolatot hozna létre és felszabadítaná a B2 bázist.