- 3-D caratteristiche Strutturali di SeHAS
- Elementi sottostrutturali (SSE) in Classe I HA
- I siti di legame dei substrati UDP si sovrappongono
- Lys-139 è dispensabile in SeHAS ed ha un ruolo nel legame del substrato
- SSE5 si lega al polimero e influenza la produzione di HA
- Gln-248 (SSE7) è critico con un ruolo plausibile nella transizione di conformazione
- SSEs mostra un movimento coordinato
- Riduzione dell’allungamento del polimero finale in SeHAS, un meccanismo plausibile in tre fasi
- La reazione della glicosiltransferasi si verifica probabilmente in più passaggi
- Proposto tre fasi reazione glicosiltransferasi
3-D caratteristiche Strutturali di SeHAS
Un modello strutturale di SeHAS sequenza è stata generata utilizzando RaptorX webserver26. Il modello è stato ottenuto con il modello di cellulosa sintasi (PDB: 4P00).L’enzima modello condivide un’elevata somiglianza funzionale e una bassa somiglianza di sequenza (~15%) con SeHAS25. Nonostante la scarsa somiglianza della sequenza con il modello, il modello ottenuto è di alta qualità come indicato dalle misure di qualità globale (valore P: 10-8) e assoluta (punteggio GDT: 52) 26. La valutazione della qualità stereo-chimica del modello strutturale indica che il 98,5% dei residui risiede nella regione consentita/parzialmente consentita del terreno di Ramachandran.
La figura 1 mostra il modello strutturale di SeHAS. Il modello strutturale HAS mostra che la singola catena si piega in tre componenti: (i) un dominio funzionale della glicosiltransferasi, (ii) quattro eliche transmembrana (TM1-TM4) e (iii) tre eliche anfipatiche (AP1-AP3). Il dominio della glicosiltransferasi adotta GT-Una piega formata da un foglio β misto a 7 filamenti circondato da eliche α nell’architettura β/α. Le eliche transmembrane (TM1-TM4) formano un fascio di quattro eliche e creano un poro per la traslocazione del polimero. 11 Si prevede che i residui C-terminali di SEHA siano disordinati e non mostrati in Fig. 1. La natura oligomerica dei SEHA è ancora in fase di studio. Fino al 2018, SeHAS era caratterizzato per funzionare nella sua forma monomerica9. Rapporti recenti indicano che l’enzima SeHAS funziona come omodimero27. Lo scopo del presente lavoro è limitato alla valutazione delle caratteristiche nel protomero.

Modello strutturale e caratteristiche di SeHAS. SSE: Elemento sottostrutturale, AP: Elica anfipatica, TM: Elica trans-membrana.
Il modello strutturale 3-D di SeHAS è coerente con la topologia precedentemente determinata di HA in Streptococcus pyogenes derivato facendo uso della fusione, dell’etichettatura e degli esperimenti di accessibilità della proteasi 12,16,19 con una leggera differenza nel numero delle eliche anfipatiche. Proponiamo la presenza di tre eliche anfipatiche invece di due eliche anfipatiche precedentemente riportate sulla base di una valutazione comparativa con la struttura della cellulosa sintasi. I residui di SeHAS corrispondenti all’elica anfipatica AP2 non sono stati sondati specificamente per la loro posizione cellulare16. Come discusso più avanti in questo manoscritto, questa elica contiene residui di importanza funzionale.
Il modello strutturale spiega i risultati dell’inibizione della N-etilmaleimide (NEM) in SeHAS19. NEM reagisce con i gruppi tiolici e viene quindi utilizzato per sondare il ruolo dei residui di cisteina nelle proteine. SeHAS ha quattro residui di Cys: Cys-226, Cys-262 e Cys-281 e Cys-367. I primi tre residui di cisteina si trovano nel citosol e sono quindi accessibili al NEM che porta all’inibizione. Cys-367, tuttavia, si trova in transmembrane helix ed è inaccessibile a NEM. Pertanto, non è riportata alcuna inibizione per questo residuo. In presenza di substrato, NEM si lega solo a Cys-281. I nostri studi strutturali (descritti più avanti) indicano che Cys-226 e Cys-262 si trovano in prossimità del sito di legame UDP-substrato e la presenza di substrato bloccherebbe quindi l’accesso di NEM a questi residui. Cys-281 si trova lontano dal sito di legame UDP e la presenza di substrato non blocca questo sito dall’inibizione NEM.
Elementi sottostrutturali (SSE) in Classe I HA
Ci sono poche informazioni sulle macchine funzionali specifiche per la classe I HA. In assenza di struttura 3-D, non è noto un ruolo funzionale dei siti studiati sperimentalmente. Quindi, per ottenere una comprensione sui componenti funzionali in SEHA e la loro disposizione relativa in 3-D, identifichiamo brevi regioni contigue con caratteristiche di sequenza conservate evolutivamente chiamate elementi sub-strutturali (SSE). Abbiamo confrontato 81 Classe I HA sequenze ottenute attraverso criteri di selezione rigorosi elaborati nella sezione Metodi. La classe I HA enzimi che differiscono nel numero di eliche transmembrana. In assenza di informazioni strutturali, l’allineamento in questa regione è di scarsa qualità. Quindi, il confronto delle sequenze è limitato alla regione citosolica per evitare siti con corrispondenza residuo-residuo ambigua. L’allineamento delle sequenze HAS Classe I è fornito come Fig supplementare. S1, creato con Jalview. Un punteggio di conservazione è calcolato per ogni corrispondenza residuo-residuo rispetto alla sequenza SeHAS. Un tratto contiguo con punteggio medio >=70 e almeno 2 siti con punteggio > =80 è definito come elemento sub-strutturale (SSE). Utilizzando questi criteri, identifichiamo 9 elementi sub-strutturali, etichettati SSE1-SSE9, di potenziale importanza strutturale / funzionale in HAS (Fig. 2). Struttura secondaria per la maggior parte delle mappe SSEs ai loop tranne SSE5, SSE8 e SSE9 che si verificano nelle eliche. Questi elementi sono contrassegnati anche in Fig. 1. La tabella 1 riassume i dettagli della sequenza e il ruolo strutturale e funzionale di SSE.

Un appezzamento di punteggio di conservazione rispetto al numero di sequenza SeHAS. SSE indicato in alto. La proiezione della struttura secondaria della sequenza è indicata in basso. I fili sono contrassegnati come frecce e le eliche rappresentate come rettangoli. I rettangoli pieni corrispondono alle eliche anfipatiche. Consultare il testo per i dettagli.
I nostri rapporti di studio hanno conservato SSES: SSE5 e SSE7 specifici per HAS. Mutazioni studiate finora, corrispondenti ai residui Tyr-74, Asp-159, Ser-218, Cys-226. Leu-230, Tyr-233, Arg-234, Asp-259, Asp-260, Arg-261, Leu-263, Cys-281, Gln-295, Gln-296, Asn-297, Arg-298, Trp-299, Arg-406, Arg-413, hanno dimostrato di influenzare l’attività. Mutazioni corrispondenti ai residui Lys-48, Glu-327, Lys-414,Lys-415 influenzano la velocità di reazione e/o il peso molecolare del polimero ha18,19,20,21, 23. La maggior parte di questi siti di mutazione si associa a SSE1-4, 6, 8 e 9 (Tabella 1).Altri siti non sono una caratteristica conservata di Classe I HA famiglia. Bi et al. (2015) ha analizzato diverse glicosiltransferasi processive e discusso la presenza di tre residui di Asp variamente distanziati nel dominio della glicosiltransferasi, che sono cruciali per l’attività25. Questi includono, Asp da SSE1 nel legame nucleotidico, Asp di SSE2 nel legame con il metallo, Asp in SSE8 con un probabile ruolo di base. Inoltre, un probabile ruolo nel legame polimerico è suggerito per i residui di SSE9. Weigel (2015) ha proposto otto Asp/Glu contenenti tri-peptidi come potenziali regioni coinvolte nel legame UDP-zucchero12. Al fine di chiarire il ruolo di SSE e identificare le regioni che si legano agli zuccheri UDP, abbiamo condotto simulazioni di docking.
Si prevede che l’enzima HAS abbia almeno due siti di legame, uno per i substrati UDP-zucchero e l’altro per lo zucchero polimerico per catalizzare una formazione di legame glicosidico12. Per identificare i siti di legame nella struttura enzimatica, abbiamo condotto studi di docking su substrati UDP-zucchero: UDP-N-acetilglucosamina e UDP-acido glucuronico. La regione di legame per i substrati UDP viene valutata attraverso una griglia con il suo centro nel dominio della glicosiltransferasi come definito nei Metodi.
I siti di legame dei substrati UDP si sovrappongono
Le simulazioni di docking sono condotte separatamente per UDP-N-acetilglucosamina e UDP-acido glucuronico. Sono selezionati conformer a bassa energia (meglio di 5 kcal/mol). La figura 3A mostra la frequenza dei contatti di vari siti con conformatori energeticamente favorevoli attraverso diverse piste di simulazione. Sono mostrati residui polari con una frequenza di almeno il 10% su uno qualsiasi dei due substrati. L’osservazione notevole dalla figura è che i siti di legame per i due substrati di zucchero si sovrappongono.

(A) Frequenza dei residui di contatto del ligando per conformatori energeticamente favorevoli di UDP-N Acetilglucosamina (UDP-GlcNAc) e UDP – D Acido glucuronico (UDP-GlcA). La frequenza viene tracciata sull’asse X e i siti sull’asse Y. (B) Ruolo di SSE1–4, SSE8 e SSE9 nel legame del substrato UDP-zucchero. (C) Ruolo di SSE6 nel legame del ligando. (D) Ruolo di SSEs nel legame polimerico. E) Ruolo dell’SSE7. (i) Anello SSE7 in ialuronano sintasi, (ii) anello equivalente in cellulosa sintasi, (iii) anello equivalente in glicosiltransferasi non processuale. (F) L’energia minimizzata HA struttura che mostra UDP-N-Acetilglucosamina e disaccaride di acido glucuronico e N-acetilglucosamina moeities.
Il ruolo dei residui di contatto è stato valutato studiando il legame con il conformatore energeticamente più favorevole biologicamente rilevante. La selezione del conformatore è guidata dalla vicinanza dell’anello nucleotidico di UDP al SSE1 evolutivo conservato noto per essere coinvolto nel legame nucleotidico. I conformer selezionati nella tasca di rilegatura sono mostrati in Fig. 3B. SSE1-SSE4, SSE6, SSE8 e SSE9 sono coinvolti nel legame del substrato (Fig. 3 TER). SSE1, SSE2 e SSE4 stabilizzano in gran parte la parte uridinica dei substrati mentre SSE3, SSE8 e SSE9 interagiscono con l’anello zuccherino. Il legame iniziale dell’UDP-ring del substrato con l’enzima potrebbe essere facilitato da (i) catena laterale di Asp-103 conservato di SSE2 (blu, Fig. 3B) attraverso legami idrogeno con gruppi polari di nucleotidi e (ii)mediante anello aromatico di Tyr-74 (verde, Fig. 3B) da SSE1 attraverso le interazioni π-π con l’anello uridinico di UDP. Catena laterale di Glu – 76 (verde, Fig. 3B) da SSE1 forma legami idrogeno con gruppi polari di zucchero ribosio di UDP. Il residuo Asp-161 di SSE4 stabilizza il gruppo OH dell’anello ribosio, mentre Asp-159 stabilizza lo ion metallico. Gln-295 e Arg-298 (blu) da SSE9 potrebbero interagire e stabilizzare il gruppo pirofosfato del nucleotide UDP. NE atomo di Trp-299 è in H-bonding distanza al substrato di zucchero e probabilmente aiuta a orientare il substrato. Asp-260 è topologicamente equivalente alla base catalitica nella sintesi di cellulose25. SSE8 contiene Asp-260. Sequenzialmente prossimale a questo residuo sono Asp-259 e Arg-261 entrambi i quali interagiscono con i gruppi polari dell’anello di zucchero (verde). Il residuo Arg-140, accanto a Lys-139, è parzialmente conservato e sostituito solo con Lys negli omologhi SeHAS. Questo residuo si trova in prossimità dell’estremità N-terminale dell’elica che tiene SSE8 (verde). Questa estremità contiene residui Asp caricati negativamente che potrebbero essere neutralizzati da Arg-140.
Residui di SSE6 (Fig. 3C) creare uno scaffold per supportare i ligandi nel sito di rilegatura. Il ciclo è posizionato strategicamente e forma la base della tasca vincolante. Il ciclo si trova anche vicino alla base catalitica (SSE8) e allo zucchero polimerico legato (discusso più avanti). Come discusso sopra, gli esperimenti che utilizzano N-ethlymaleimide collocano il Cys-226 conservato di questo elemento vicino al sito di legame UDP-sugar19. Questo è probabilmente coinvolto nel mantenimento del pKa del microambiente nel sito attivo. Sebbene non sia essenziale per l’attività, la mutazione di questo residuo in Ala ha dimostrato di influenzare l’attività in SeHAS19, 28. La catena laterale di Ser-227 è probabilmente coinvolta nella stabilizzazione della conformazione del ciclo attraverso le interazioni con la catena principale. Gly-228 e Pro-229 forniscono rispettivamente la flessibilità e la rigidità necessarie alla conformazione della catena principale (Fig. 3 QUATER).
Lys-139 è dispensabile in SeHAS ed ha un ruolo nel legame del substrato
Le valutazioni di aggancio suggeriscono un ruolo di Lys-139 nel legame del legante. Studi precedenti hanno riportato un ruolo normativo per questo residuo nelle forme di mammiferi di HAS. Nel topo, una mutazione in Arg provoca una perdita completa di attività24. In assenza di studi mutazionali in SEHA, per chiarire ulteriormente il suo ruolo, abbiamo condotto studi di mutazione di Lys-139. Dettagli sulla configurazione sperimentale e saggio sono descritti in Metodi. I risultati sperimentali e la mappa vettoriale pMBAD utilizzata per lo studio sono mostrati in Fig. 4A, B, rispettivamente. Abbiamo mutato Lys-139 in Arg (K139R) con l’obiettivo di conservare la carica in quella posizione. La mutazione non ha portato alla completa perdita di attività, ma ha avuto un impatto. Solo il 34% di attività (produzione di HA) è stato mantenuto rispetto al controllo che ribadisce un ruolo funzionale significativo di questo residuo (Fig. 4 BIS). Per sondare ulteriormente l’interazione basata sulla carica tra questo residuo e substrato, abbiamo mutato Lys-139 caricato positivamente in Asp caricato negativamente (K139D). La carica negativa sul sito porta al mantenimento dell ‘ 82% di attività (produzione di HA) rispetto al controllo. Questa analisi suggerisce un ruolo per questo residuo nella stabilizzazione dei gruppi polari del substrato. La selezione delle sostituzioni illustra ulteriormente che i gruppi con carica positiva e negativa sono ospitati nel sito. I nostri studi dimostrano che questo residuo influenza direttamente l’attività della sintasi nei SEHA. Mutazioni in questo sito compromettono la funzione sintasi a livelli considerevoli.

Studi di mutazione su SEHA. (A) Attività relativa dei mutanti SEHA condotta in questo studio. Gli esperimenti sono stati condotti in triplicati e l’errore standard per il titolo HA era compreso tra ±0,01 e ±0,05. (B) Costrutto vettoriale pMBAD. Geni hasA e hasB da Streptococcus equi subsp. zooepidemicus sono stati clonati in sequenza. Per gli studi mutazionali, hasA wildtype è stato sostituito con mutanti corrispondenti.
SSE5 si lega al polimero e influenza la produzione di HA
La cavità sopra la regione di legame UDP-substrato formata da eliche anfipatiche viene valutata per il legame dell’unità polimerica. Lo studio sul legame polimerico è limitato al disaccaride terminale coinvolto nella formazione del legame glicosidico. Sono stati condotti studi di docking con unità disaccaridica HA comprendente una N-acetilglucosamina legata a β 1-4 e acido D-glucuronico nel dominio della glicosiltransferasi. Sono stati selezionati conformatori energeticamente favorevoli. La figura 3D mostra un’unità di disaccaridi HA ancorata vicino alla tasca di rilegatura. SSE5, SSE8 e SSE9 sono coinvolti nel legame (Fig. 3D). Residuo Asp-260 da SSE8 è in H-distanza di legame al terminale OH gruppo del polimero ed è indicato da una linea tratteggiata in Fig. 3D. Arg-261 di SSE8 si trova vicino al polimero e potrebbe interagire con i gruppi OH polari dello zucchero. Il residuo Trp-299 da SSE9 forma interazioni CH-π con lo zucchero terminale.
Per quanto a nostra conoscenza, questo è il primo rapporto che ipotizza il coinvolgimento funzionale dei residui da SSE5. I residui chiave in SSE5 coinvolti nel legame con il polimero sono Arg-205, Tyr-206, Phe-210 e Arg-214. Arg-205 si trova in prossimità del disaccaride ancorato e coinvolto nelle interazioni con i gruppi polari caricati negativamente della porzione di zucchero. Tyr-206 o fenilalanina in omologhi SeHAS è visto per stabilizzare il residuo Arg-205 attraverso interazioni catione-π. Arg-214 o Lys in sequenze omologhe è in prossimità del polimero e vicino a Phe-210 parzialmente conservato con cui forma interazioni catione-π. La conseguenza della mutazione dei residui di SSE5 non è nota. Qui, sondiamo la conseguenza della mutazione di Tyr-206 e Arg-214 sulla funzione attraverso la mutagenesi diretta al sito. I nostri risultati sperimentali mostrano che l’interruzione delle interazioni catione-π mutando la tirosina aromatica in alanina (Y206A) provoca una perdita del 99% dell’attività HA (produzione HA) (Fig. 4 BIS). La perdita di questa interazione potrebbe aver influenzato indirettamente il legame del polimero attraverso l’adiacente Arg-205. Allo stesso modo, la mutazione del residuo basico di arginina a 214 in alanina (R214A) porta alla completa perdita di funzione (Fig. 4 BIS). È interessante notare che l’introduzione della carica negativa (R214E) porta alla perdita di funzione del 93% (Fig. 4 BIS). Questi risultati iterano la necessità di una carica positiva netta in questo sito al fine di facilitare il legame e la traslocazione del polimero. Queste mutazioni indicano l’interdipendenza delle attività di legame/traslocazione dei polimeri e della glicosiltransferasi.
Inoltre, l’enzima complessato con i due ligandi (UDP-zucchero e disaccaride) è stato ridotto al minimo l’energia utilizzando campi di forza AMBRA. La figura 3F mostra l’enzima legato a UDP-N-acetilglucosamina e disaccaride formato da acido glucuronico collegato e N-acetilglucosamina con acido glucuronico all’estremità polimerica. I dettagli sul protocollo di minimizzazione sono descritti in Metodi.
Gln-248 (SSE7) è critico con un ruolo plausibile nella transizione di conformazione
Gln-248 è un residuo conservato in SSE7, un ciclo lungo a partire dal sito obbligatorio. Il ciclo equivalente in entrambi gli omologhi processive e non processive è sequenzialmente diverso e mostra conformazioni distinte in forme enzimatiche legate al substrato e non legate (Fig. 3E (ii)) 29,30,31 e Fig. 3E (iii) β 1-4 galattosiltransferasi, codice PDB: 2FYD e 2FY7)32. È probabile che il loop in SeHAS faciliti il posizionamento di SSE8 per la catalisi. Il residuo Gln-248 si trova lontano dalla tasca legante; il ruolo esatto di questo residuo non poteva essere previsto sulla base di questi studi in-silico. Studi di mutazione interni mostrano che questo residuo è importante. La sostituzione del residuo con Ala comporta una perdita quasi completa della produzione di HA (Fig. 4 BIS).Il ruolo di questo residuo è ulteriormente sondato attraverso studi dinamici a grana grossa ed è discusso in una sezione successiva.
SSEs mostra un movimento coordinato
Il paradigma attuale è structure-encodes-dynamics-encodes-function33,34,35. È sempre più riconosciuto che le fluttuazioni casuali degli atomi nel loro stato nativo nascondono un movimento coordinato che predispone la proteina a cambiamenti funzionalmente rilevanti nella struttura. Questi movimenti possono essere catturati da modalità a bassa frequenza in elastic network modeling. Questi modi sono noti per essere insensibili ai dettagli strutturali ed energetici. Quindi abbiamo usato Anisotropic Network Modeling (ANM), un approccio basato su ENM per catturare immagini globali di dinamiche codificate dalla struttura 3-D di SEHA. Abbiamo usato ProDy36 per i calcoli ANM. Ulteriori dettagli sono elaborati nella sezione Metodi. Il movimento coordinato è rappresentato come valori di coefficiente di correlazione tra i nodi della rete ANM. I valori medi del coefficiente di correlazione sono stati calcolati in base alle prime 50 modalità. Figura 5A mostra la mappa di correlazione per SeHAS. I valori del coefficiente di correlazione positiva sono indicativi di atomi che si muovono nella stessa direzione. Cluster di residui spazialmente prossimali con alto coefficiente di correlazione sono considerati strutturalmente e funzionalmente importanti. Le coppie di residui con grandi valori positivi corrispondono a elementi sub-strutturali. Inoltre, la correlazione tra coppie di residui si estende a regioni attraverso diversi SSE. SSE1-4 forma un sottodominio strettamente interagente (rettangolo nero). Allo stesso modo, SSE5-9 forma un sottodominio interagente coordinato (rettangolo grigio). I due sottodomini sono separati da una regione scarsamente correlata. I moti globali intrinseci illustrano la coordinazione funzionale richiesta rispetto al legame del substrato ad un’estremità, da SSE1 – 4 e dal legame del polimero all’altra estremità (SSE5-9).

Valutazione delle dinamiche globali in SeHAS. A) Valori medi del coefficiente di correlazione per le SEHA tra coppie di residui. Valori medi dei coefficienti di correlazione per Gln-248 (B) e Thr-283 (C) con altri residui di SeHAS.
Abbiamo ulteriormente esplorato la dinamica dei SEHA rispetto al residuo Gln-248. Fico. 5B mostra la distribuzione dei valori del coefficiente di correlazione rispetto ad altri residui in SEHA. Il Gln-248 mostra grandi valori positivi con SSE8, 9 e SSE3 che contengono residui di legame catalitico e substrato. Un movimento coordinato con questi SSEs valutato attraverso ANM illustra ulteriormente il suo ruolo nelle dinamiche di conformazione funzionalmente rilevanti.
Lo studio ANM è esteso per valutare l’effetto della mutazione sui valori del coefficiente di correlazione. Per ciascuno dei mutanti, si ottiene un modello strutturale usando RaptorX26. I mutanti mostrano un’elevata sovrapposizione strutturale con un RMSD medio di circa 1 Å su tutti gli atomi rispetto alla struttura della proteina WT. Per ogni struttura mutante, i valori del coefficiente di correlazione rispetto al residuo mutante sono calcolati e confrontati con il peso. Le trame sono mostrate in Fig. S2. Le mutazioni al sito 214, 248 e 283 mostrano una differenza sostanziale nei valori nelle regioni SSE.
Riduzione dell’allungamento del polimero finale in SeHAS, un meccanismo plausibile in tre fasi
Nei membri prototipici della famiglia di glicosiltransferasi GT-2 come la cellulosa sintasi, la biosintesi del polimero si verifica dall’estremità non riducente del polimero in crescita25,31. In tali sistemi, i substrati UDP agiscono come donatori trasferendo lo zucchero allo zucchero polimerico che funge da accettore24. Un β-legame tra gli zuccheri è creato da precursori zucchero-UDP α-linked attraverso una reazione di sostituzione SN2 spostamento diretto. In questa reazione, una fase di deprotonazione da parte di una base catalitica funzionalizza l’accettore24. L’attacco nucleofilo di questo gruppo di zucchero accettore sul donatore tramite un singolo stato di transizione ionico-simile all’ossocarbenio provoca una reazione di trasferimento glicosilico con il rilascio di UDP dallo zucchero donatore e l’inversione netta della stereochimica a carbonio anomerico. Questo meccanismo è illustrato in Fig. 6A. SEHAS differisce da questo prototipo. È noto che l’HA si allunga dall’estremità riducente12. Ciò implica (i) l’UDP viene rilasciato dall’estremità polimerica e non dai substrati UDP durante la catalisi e (ii) l’inversione del donatore e degli accettori con HA-UDP che agisce come donatore e UDP-substrato di zucchero come accettore. Sulla base del panorama del legante e delle conoscenze acquisite sull’architettura del sito attivo, discutiamo la partecipazione dei ligandi come donatore e accettore e proponiamo un meccanismo catalitico per il trasferimento di glicosile nei SEHA (vedi Fig. 6 TER).
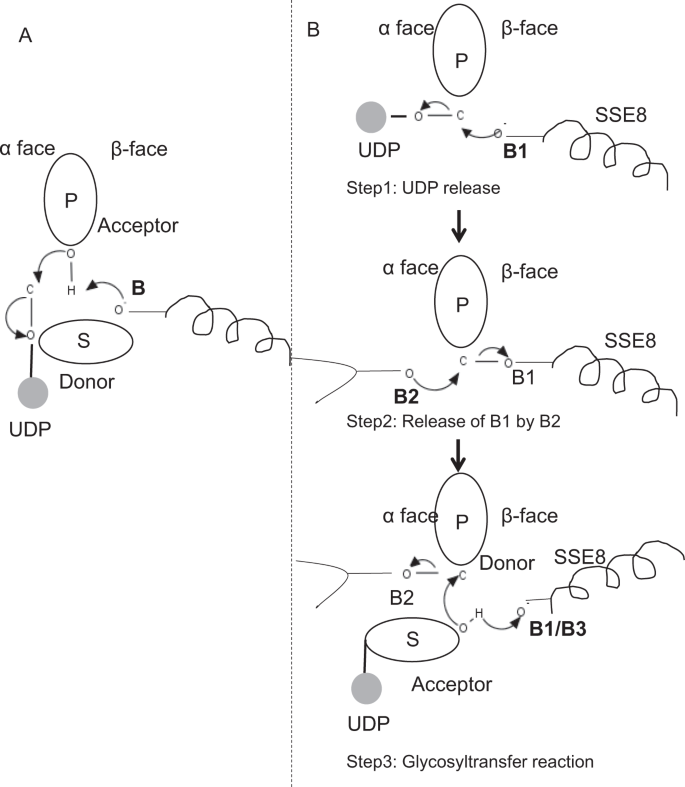
Meccanismo molecolare proposto in SeHAS. (A) Meccanismo in una glicosiltransferasi prototipica con chimica di inversione. (B)Meccanismo proposto nella classe I HA. P: Zucchero polimerico, S: Zucchero di substrato.UDP è indicato come un cerchio. B1, B2 e B3 sono le basi catalitiche che partecipano al meccanismo di reazione.
La reazione della glicosiltransferasi si verifica probabilmente in più passaggi
Come primo passo, abbiamo esplorato la possibilità di una reazione della glicosiltransferasi a passo singolo in modo simile alla cellulosa sintasi. Se la reazione glicosiltransferasi si verifica in un unico passaggio, l’enzima in un dato momento dovrebbe contenere due parti UDP, una attaccata al polimero e l’altra attaccata al substrato in entrata. Nello scenario multi-step alternativo, l’UDP dal polimero viene rilasciato prima che si verifichi la reazione catalitica. In questo caso, per creare inversione netta di stereochimica, reazione avverrebbe in una serie di numero dispari di passi con meccanismo SN2. Per valutare quale scenario è più probabile, abbiamo condotto studi di legame UDP attraverso l’attracco di molecole UDP nel dominio della glicosiltransferasi. La valutazione indica una significativa sovrapposizione di siti di legame UDP e UDP-substrato.Il risultato è presentato nella Sezione supplementare. Una conformazione energeticamente favorevole esemplare di UDP con substrato e polimero regioni leganti sono mostrati in Fig supplementare. S3. Sebbene la valutazione sia basata sul modello statico, il posizionamento di due grandi molecole di natura chimica simile in prossimità di requisiti di ambienti fisiochimici simili è improbabile per questo enzima. Ipotizziamo che un passaggio rivestito con residui caricati positivamente da SSE9 e ioni metallici potrebbe facilitare il rilascio di UDP dall’estremità polimerica. Anche il coinvolgimento dello metal metallico nella glicosiltransferasi per il rilascio di UDP è ben documentato24. Poiché i due siti UDP non si escludono a vicenda, il secondo scenario di reazione multi-step appare più probabile.
Una volta che UDP viene rilasciato dal polimero, un attacco nucleofilo dal gruppo OH del substrato-UDP (accettore) creerebbe un legame glicosidico. Per creare l’inversione, il rilascio di UDP e il successivo attacco nucleofilo devono avvenire da due facce opposte di zucchero polimerico. Proponiamo il ruolo di tre catalizzatori di base nello schema di reazione generale che si trovano sulle facce α e β dello zucchero donatore all’estremità del polimero. Questi passaggi sono illustrati attraverso Fig. 6B e descritto di seguito.
Proposto tre fasi reazione glicosiltransferasi
Step1: UDP rilascio: Asp-260 da SSE8 potrebbe agire come base (B1) e avviare il rilascio di UDP molecola da polimero (donatore) da α-face. Questo passaggio creerebbe un intermedio glicosilico legato covalentemente schermato sulla faccia β con la base B1. Per creare un’inversione questa faccia dello zucchero deve essere libera per l’attacco nucleofilo da parte del gruppo O-H di zucchero in entrata. Quindi un punto intermedio, con l’attacco nucleofilo dal fronte del α libererebbe il fronte del β pronto per l’attacco nucleofilo dallo zucchero del accettore.
Fase 2: rilascio di B1 da B2; Esplorare il ruolo di Thr-283: la base B2 sulla faccia α dello zucchero donatore effettuerebbe un attacco nucleofilo sul carbonio anomerico al centro di reazione e rilascerebbe B1. I nostri studi strutturali mostrano Gln-295 e Thr-283 conservati su questa faccia. Il rilascio di UDP potrebbe provocare cambiamenti conformazionali e portare uno di questi residui in prossimità dello zucchero donatore per la catalisi. La mutazione di Gln-295 provoca fino al 90% di perdita di attività, ma il ruolo di base non è noto20. Abbiamo valutato la possibilità di un Thr-283 conservato che risiede in un ciclo per funzionare come seconda base. Abbiamo mutato Thr a Ser contenente un simile gruppo funzionale OH e ad Ala con piccola catena laterale alifatica. Entrambi i mutanti T283A e T283S mostrano una perdita del 95% della produzione di HA (Fig. 4 BIS). Questo residuo presenta una correlazione positiva con le regioni SSE4 e SSE6 e una regione spazialmente prossimale tra il residuo 186 e il residuo 190 (Fig. 5 QUATER). Il residuo 188, sebbene non conservato, si trova in prossimità del substrato ancorato (Fig. 3). Thr-283 non mostra un’elevata correlazione positiva con SSE8 che tiene la base catalitica. È possibile che il residuo agisca come residuo di base di supporto durante la reazione catalitica con il suo movimento coordinato con la regione di legame del substrato spazialmente prossimale indipendente dalla base Asp-260 in SSE8. Ulteriori esperimenti sarebbero necessari per dimostrare il suo ruolo di base. Nel complesso, lo studio evidenzia ancora un altro residuo funzionalmente critico, non noto in precedenza.
Fase 3: Reazione di trasferimento glicosilico: una volta rilasciato B1, la faccia β del carbonio anomerico dello zucchero polimerico viene sbloccata per la reazione. La deprotonazione del substrato-UDP sulla stessa faccia da una terza base creerebbe un gruppo nucleofilo. Questo passaggio potrebbe essere avviato da B1 o da un’altra base B3. Asp-259, accanto a B1 è un residuo altamente conservato in prossimità del substrato-UDP e potrebbe agire come B3. Tuttavia, B1 / B3 è più vicino allo zucchero polimerico (donatore) come discusso nel passaggio 1. Per iniziare deprotonation, B1 deve essere in prossimità di zucchero accettore. Potrebbe essere raggiunto attraverso cambiamenti di conformazione a SSE8 assistito da SSE7. L’elica equivalente in sintasi della cellulosa tiene la base catalitica e subisce le transizioni conformazionali coordinate per la reazione e la traslocazione della glicosiltransferasi. Un attacco nucleofilo dello zucchero accettore sul carbonio anomerico dello zucchero donatore creerebbe un legame glicosidico e il rilascio della base B2.