- 3-D structurele kenmerken van SeHAS
- Substructurele elementen (SSE) van klasse I hebben
- bindingsplaatsen van UDP-substraten overlappen
- Lys-139 is overbodig in SeHAS en heeft een rol in substraatbinding
- SSE5 bindt aan polymeer en beïnvloedt HA productie
- Gln-248 (SSE7) is kritisch met een plausibele rol in conformatie transitie
- SSE ‘ s vertonen gecoördineerde beweging
- reducerende eindpolymeer elongatie in SeHAS, een plausibel driestapsmechanisme
- Glycosyltransferasereactie treedt waarschijnlijk op in meerdere stappen
- voorgestelde drie-stappen glycosyltransferasereactie
3-D structurele kenmerken van SeHAS
een structureel model van SeHAS-sequentie werd gegenereerd met behulp van RaptorX webserver26. Het model werd verkregen met cellulose synthase template (PDB: 4P00).Het template enzym deelt een hoge functionele gelijkenis en een lage sequentie gelijkenis (~15%) met SeHAS25. Ondanks de slechte sequentie gelijkenis met de template, het verkregen model is van hoge kwaliteit, zoals aangegeven door de Globale (p waarde: 10-8) en absolute (GDT score: 52) kwaliteitsmaten26. Stereo-chemische kwaliteitsbeoordeling van het structurele model geeft aan dat 98,5% van de residuen in toegestane/gedeeltelijk toegestane regio van het perceel Ramachandran wonen.
figuur 1 toont het structurele model van SeHAS. Het heeft structurele model toont aan dat de enkele ketting vouwt in drie componenten: (i) een functioneel glycosyltransferasedomein, (ii) Vier transmembrane helices (TM1-TM4) en (iii) drie amfipathische helices (AP1-AP3). Het glycosyltransferase-domein keurt GT-een vouw goed die door gemengd 7-vastgelopen β-blad wordt gevormd dat door α-helices in β/α-architectuur wordt omringd. Transmembrane helices (TM1-TM4) vormen een vier helix bundel en creëren een porie voor polymeer translocatie. 11 C-eindresidu ‘ s van SeHAS zullen naar verwachting ongeordend zijn en niet in Fig. 1. De oligomere aard van SeHAS wordt nog onderzocht. Tot 2018 werd SeHAS gekenmerkt om te functioneren in zijn monomere vorm9. Recente rapporten wijzen op sehas enzym functies als homodimer27. De reikwijdte van dit werk is beperkt tot de beoordeling van kenmerken in de protomeer.

structureel model en eigenschappen van SeHAS. SSE: Substructural element, AP: Amphipathic helix, TM: Trans-membraan helix.
het 3-D structurele model van SeHAS is consistent met eerder bepaalde topologie van HAS in Streptococcus pyogenes afgeleid met behulp van fusie, etikettering en protease toegankelijkheidsexperimenten 12,16,19 met een klein verschil in het aantal amfipathische helices. We stellen de aanwezigheid van drie amfipathische helices in plaats van twee amfipathische helices eerder gemeld op basis van vergelijkende beoordeling met cellulose synthase structuur. SeHAS-residuen die overeenkomen met amfipathische helix AP2 zijn niet specifiek onderzocht voor hun cellulaire lokatie16. Zoals later in dit manuscript besproken, bevat deze helix resten van functioneel belang.
het structurele model verklaart de resultaten van n-ethylmaleimide (NEM) remming in SeHAS19. NEM reageert met thiolgroepen en wordt daarom gebruikt om de rol van cysteine residuen in eiwitten te onderzoeken. SeHAS heeft vier Cys-residuen: Cys-226, Cys-262 en Cys-281 en Cys-367. De eerste drie cysteïneresiduen bevinden zich in cytosol en zijn daarom toegankelijk voor NEM, wat leidt tot remming. Cys-367, echter, bevindt zich in transmembrane helix en is ontoegankelijk voor niet. Daarom wordt voor dit residu geen remming gemeld. In aanwezigheid van substraat wordt aangetoond dat NEM alleen aan Cys-281 bindt. Onze structurele studies (later beschreven) geven aan dat Cys-226 en Cys-262 zich in de nabijheid van UDP-substraat bindingsplaats bevinden en de aanwezigheid van substraat zou dus de toegang van niet tot deze residuen blokkeren. Cys-281 ligt weg van de UDP-bindingsplaats en de aanwezigheid van substraat blokkeert deze plaats niet van NEM remming.
Substructurele elementen (SSE) van klasse I hebben
er is weinig informatie over de functionele machines die specifiek zijn voor klasse I hebben. Bij afwezigheid van 3-D structuur is een functionele rol van experimenteel bestudeerde locaties niet bekend. Om inzicht te krijgen in de functionele componenten in SeHAS en hun relatieve dispositie in 3-D, identificeren we korte aaneengesloten regio ‘ s met evolutionair behouden sequentiekenmerken die substructurele elementen (SSE) worden genoemd. We vergeleken 81 Klasse I heeft sequenties verkregen door middel van strenge selectiecriteria uitgewerkt in methoden sectie. Klasse I heeft enzymen verschillen in het aantal transmembrane helices. Bij gebrek aan structurele informatie is de afstemming in deze regio van slechte kwaliteit. Vandaar, is de vergelijking van opeenvolgingen beperkt tot het cytosolic gebied om plaatsen met dubbelzinnige residu-residu correspondentie te vermijden. De uitlijning van HAS klasse I sequenties wordt verstrekt als aanvullende Fig. S1, gemaakt met Jalview. Een conservatiescore wordt berekend voor elke residu-residu-correspondentie met betrekking tot SeHAS-sequentie. Een aaneengesloten stuk met een gemiddelde score > = 70 en ten minste 2 plaatsen met een score > = 80 wordt gedefinieerd als substructureel element (SSE). Aan de hand van deze criteria identificeren we 9 substructurele elementen, aangeduid als SSE1-SSE9, van potentieel structureel/functioneel belang in HAS (Fig. 2). Secundaire structuur voor de meeste SSEs kaarten aan lussen behalve SSE5, SSE8 en SSE9 die voorkomen in helices. Deze elementen zijn ook aangegeven in Fig. 1. Tabel 1 geeft een overzicht van de sequentiedetails en de structurele en functionele rol van SSE.

een grafiek van de conservatiescore met betrekking tot sehas volgnummer. SSE bovenaan aangegeven. De secundaire structuurprojectie van de sequentie wordt onderaan aangegeven. De strengen zijn gemarkeerd als pijlen en helices weergegeven als rechthoeken. Gevulde rechthoeken komen overeen met amfipathische helices. Raadpleeg de tekst voor details.
onze studie rapporten behouden SSEs: SSE5 en sse7 specifiek voor HAS. Tot nu toe bestudeerde mutaties, overeenkomend met residuen Tyr-74, Asp-159, Ser-218, Cys-226. Leu-230, Tyr-233, Arg-234, Asp-259, Asp-260, Arg-261, Leu-263, Cys-281, Gln-295, Gln-296, Asn-297, Arg-298, Trp-299, Arg-406, Arg-413, hebben aangetoond de activiteit te beïnvloeden. Mutaties die overeenkomen met de residuen Lys-48, Glu-327, Lys-414, Lys-415 beïnvloeden de reactiesnelheid en/of het molecuulgewicht van de Ha-polymer18,19,20,21,23. De meeste van deze mutatieplaatsen geven een beeld van SSE1-4, 6, 8 en 9 (Tabel 1).Andere sites zijn niet een geconserveerd kenmerk van klasse I heeft familie. Bi et al. (2015) analyseerde diverse processieve glycosyltransferasen en besprak de aanwezigheid van drie variabel gespreide ASP-residuen in glycosyltransferasedomein, die cruciaal zijn voor activiteit25. Deze omvatten, Asp van sse1 in nucleotideband, Asp van SSE2 in band aan metaal, Asp in SSE8 met een waarschijnlijke rol als basis. Bovendien wordt een waarschijnlijke rol in de polymeerbinding gesuggereerd voor residuen van SSE9. Weigel (2015) stelde acht Asp/Glu bevattende tri-peptiden voor als potentiële regio ‘ s die betrokken zijn bij UDP-suikerbinding12. Om de rol van SSE te verduidelijken en regio ‘ s te identificeren die gebonden zijn aan UDP-suikers, hebben we docking simulaties uitgevoerd.
enzym heeft naar verwachting ten minste twee bindingsplaatsen, één voor UDP-suiker substraten en de andere voor polymere suiker om een glycosidebindingsvorming12 te katalyseren. Om de bindingsplaatsen in de enzymstructuur te identificeren, hebben we docking studies uitgevoerd van UDP-suiker substraten: UDP-N-acetylglucosamine en UDP-glucuronzuur. Het bindingsgebied voor UDP-substraten wordt beoordeeld door middel van een raster met zijn centrum in het glycosyltransferasedomein zoals gedefinieerd in methoden.
bindingsplaatsen van UDP-substraten overlappen
Docking simulaties worden afzonderlijk uitgevoerd voor UDP-N-acetylglucosamine en UDP-glucuronzuur. Lage energieconformatoren (beter dan 5 kcal / mol) worden geselecteerd. Figuur 3A toont de frequentie van contacten van verschillende locaties met energetisch gunstige conformers over verschillende simulatieruns. Polaire residuen met een frequentie van ten minste 10% op een van de twee substraten worden weergegeven. De opmerkelijke waarneming uit de figuur is dat de bindingsplaatsen voor de twee suiker substraten elkaar overlappen.

(A) frequentie van ligand contactresten voor energetisch gunstige conformers van UDP-N Acetylglucosamine (UDP-GlcNAc) en UDP – D glucuronzuur (UDP-GlcA). Frequentie wordt uitgezet op de X-as en Sites op de Y-as. (B) rol van SSE1–4, SSE8 en SSE9 in UDP-suiker substraatbinding. (C) rol van SSE6 in ligandbinding. D) de rol van SSE ‘ s bij de polymeerbinding. E) rol van de SSE7. (i) SSE7-lus in hyaluronan synthase, (ii) equivalente lus in cellulosesynthase, (iii) equivalente lus in niet-processieve glycosyltransferase. (F) geminimaliseerde energie heeft structuur die UDP-N-Acetylglucosamine en disaccharide van glucuronzuur en N-Acetylglucosamine moëities toont.
de rol van de contactresten werd beoordeeld door de binding met energetisch meest gunstige biologisch relevante conformer te onderzoeken. De selectie van conformer wordt geleid door de nabijheid van nucleotiderring van UDP aan evolutionair behouden sse1 gekend om bij nucleotideband te zijn betrokken. De geselecteerde conformers in het bindvak zijn weergegeven in Fig. 3B. SSE1-SSE4, SSE6, SSE8 en SSE9 zijn betrokken bij de substraatbinding (Fig. 3B). SSE1, SSE2 en SSE4 stabiliseren grotendeels het uridine deel van de substraten, terwijl SSE3, SSE8 en SSE9 interageren met de suikerring. De aanvankelijke band van de UDP-ring van het substraat met enzym zou door (I) zijketen van behouden Asp-103 van SSE2 (blauw, Fig. 3B) door waterstofbindingen met polaire nucleotidegroepen en (ii)door aromatische ring van Tyr-74 (groen, Fig. 3B) van SSE1 via π-π interacties met de uridinering van UDP. Zijketting van Glu-76 (groen, vijg. 3B) uit SSE1 vormt waterstofbindingen met polaire groepen ribosesuiker van UDP. Het residu Asp-161 van SSE4 stabiliseert de OH groep ribose ring, terwijl Asp-159 het metaalion stabiliseert. Gln-295 en Arg-298 (blauw) van SSE9 konden op elkaar inwerken en de pyrofosfaatgroep van het UDP-nucleotide stabiliseren. NE atoom van Trp-299 is in H-binding afstand tot het suiker substraat en waarschijnlijk helpt bij het oriënteren van het substraat. Asp-260 is topologisch gelijkwaardig aan de katalytische basis in cellulosesynthase25. SSE8 heeft Asp-260. Sequentieel proximaal aan dit residu zijn Asp-259 en Arg-261 die beide interageren met de polaire groepen van de suikerring (groen). Het residu Arg-140, naast Lys-139, wordt gedeeltelijk behouden en slechts door Lys in sehas-homologen vervangen. Dit residu bevindt zich in de nabijheid van het n-eindeinde van helix met SSE8 (groen). Dit einde bevat negatief geladen ASP residuen die door Arg-140 zouden kunnen worden geneutraliseerd.
residuen van SSE6 (Fig. 3C) Maak een steiger om ligands bij de bindende plaats te steunen. De lus is strategisch geplaatst en vormt de basis van bindende zak. De lus zit ook dicht bij de katalytische basis (SSE8) en de gebonden polymere suiker (later besproken). Zoals hierboven besproken, plaatsen experimenten met N-ethlymaleimide de geconserveerde Cys-226 van dit element in de buurt van UDP-suikerbindende site19. Dit is waarschijnlijk betrokken bij het behoud van de pKa van het micromilieu op de actieve plaats. Hoewel niet essentieel voor de activiteit, is aangetoond dat mutatie van dit residu in Ala de activiteit beïnvloedt in SeHAS19,28. De zijketen van Ser-227 is waarschijnlijk betrokken bij het stabiliseren van de lijnbouw door interactie met de hoofdketen. Gly-228 en Pro-229 bieden de nodige flexibiliteit en stijfheid aan de belangrijkste kettingconstructie, respectievelijk (Fig. 3C).
Lys-139 is overbodig in SeHAS en heeft een rol in substraatbinding
Docking assessments suggereren een rol van Lys-139 in ligandbinding. Eerdere studies hebben gemeld een regelgevende rol voor dit residu in zoogdiervormen van heeft. Bij muizen resulteert een mutatie in Arg in volledige activiteitsverliezen24. Bij gebrek aan mutatiestudies in SeHAS, om de rol ervan verder te verduidelijken, voerden we mutatiestudies van Lys-139 uit. Details over de experimentele opstelling en analyse worden beschreven in methoden. De experimentele resultaten en de voor het onderzoek gebruikte pmbad-vectorkaart zijn weergegeven in Fig. 4A,B, respectievelijk. Wij muteerden Lys-139 aan Arg (K139R) met het doel om de last bij die positie te bewaren. Mutatie leidde niet tot volledig verlies van activiteit, maar had wel een impact. Slechts 34% van de activiteit (HA productie) werd behouden in vergelijking met de controle, die een belangrijke functionele rol van dit residu herhaalt (Fig. 4A). Om de op lading gebaseerde interactie tussen dit residu en substraat verder te onderzoeken, muteerden we positief geladen Lys-139 tot negatief geladen Asp (K139D). Een negatieve belasting op de locatie leidt tot het behoud van 82% activiteit (HA productie) in vergelijking met controle. Deze analyse suggereert een rol voor dit residu in het stabiliseren van polaire groepen van het substraat. De selectie van substituties illustreert verder dat zowel positieve als negatief geladen groepen op de site worden ondergebracht. Onze studies tonen aan dat dit residu direct de synthase activiteit in SeHAS beïnvloedt. Mutaties op deze plaats verminderen de synthasefunctie tot aanzienlijke niveaus.

Mutatiestudies op SeHAS. (A) relatieve activiteit van sehas mutanten uitgevoerd in dit onderzoek. Experimenten werden uitgevoerd in drievoud en de standaardfout voor HA-titer lag in het bereik van ±0,01 tot ±0,05. (B) pmbad vectorconstructie. hasA-en hasB-genen van Streptococcus Equi subsp. zooepidemicus werden achtereenvolgens gekloond. Voor mutatiestudies werd het wildtype hasA vervangen door de overeenkomstige mutant(en).
SSE5 bindt aan polymeer en beïnvloedt HA productie
de holte boven het UDP – substraatbindingsgebied gevormd door amfipathische helices wordt beoordeeld op binding van polymeereenheid. Het onderzoek naar de polymeerbinding is beperkt tot het terminale disaccharide dat betrokken is bij de vorming van de glycosideverbinding. Docking studies werden uitgevoerd met HA disaccharide eenheid bestaande uit een β 1-4 gekoppeld N-acetylglucosamine en D-glucuronzuur in glycosyltransferase domein. Er werden energetisch gunstige conformatoren geselecteerd. Figuur 3D toont een ha disaccharide unit aangemeerd in de buurt van de binding pocket. SSE5, SSE8 en SSE9 zijn betrokken bij de binding (Fig. 3D). Residu Asp-260 van SSE8 bevindt zich in h-bindingsafstand tot de eindgroep OH van het polymeer en wordt aangegeven door een stippellijn in Fig. 3D. Arg-261 van SSE8 ligt dicht bij het polymeer en kan interageren met de polaire OH-groepen van de suiker. Residu Trp-299 van SSE9 vormt Ch-π interacties met de eindsuiker.
voor zover wij weten is dit het eerste rapport waarin een hypothese wordt geformuleerd over de functionele betrokkenheid van residuen van SSE5. De belangrijkste residuen in SSE5 die betrokken zijn bij de binding aan het polymeer zijn Arg-205, Tyr-206, Phe-210 en Arg-214. Arg-205 is in dichte nabijheid van aangemeerd disaccharide en betrokken bij interactie met de negatief geladen polaire groepen van suikergroep. Tyr-206 of fenylalanine in sehas-homologen wordt gezien om het Arg-205 residu door kation-π interactie te stabiliseren. Arg-214 of Lys in homologe opeenvolgingen zijn in dichte nabijheid van het polymeer en dicht bij gedeeltelijk behouden Phe-210 waarmee het kation-π interactie vormt. Het gevolg van mutatie van de residuen van SSE5 is niet bekend. Hier onderzoeken we het gevolg van het muteren van Tyr-206 en Arg-214 op functie door middel van site-directed mutagenese. Onze experimentele resultaten tonen aan dat verstoring van kation-π interacties door mutatie van de aromatische tyrosine naar alanine (Y206A) resulteert in 99% verlies van HAS activiteit (ha productie) (Fig. 4A). Verlies van deze interactie zou indirect de polymeerbinding via aangrenzend Arg-205 kunnen hebben beïnvloed. Evenzo leidt mutatie van basis arginine residu bij 214 tot alanine (R214A) tot volledig verlies van functie (Fig. 4A). Interessant, leidt de introductie van negatieve last (R214E) tot 93% functieverlies (Fig. 4A). Deze resultaten herhalen de behoefte aan een netto positieve lading op deze plaats om polymeerbinding en translocatie te vergemakkelijken. Deze mutaties wijzen op de onderlinge afhankelijkheid van polymeerbinding/translocatie en glycosyltransferaseactiviteiten.
verder werd het enzym gecomplexeerd met de twee liganden (UDP-suiker en disaccharide) geminimaliseerd met behulp van amberkleurige krachtvelden. Figuur 3F toont het enzym gebonden aan UDP-N-acetylglucosamine en disaccharide gevormd door gebonden glucuronzuur en N-acetylglucosamine met glucuronzuur aan het polymere uiteinde. De details over het minimalisatieprotocol worden beschreven in methoden.
Gln-248 (SSE7) is kritisch met een plausibele rol in conformatie transitie
Gln-248 is een geconserveerd residu in SSE7, een lange lus verwijderd van bindingsplaats. De equivalente lus in zowel processieve als niet-processieve homologen is sequentieel verschillend en vertoont verschillende conformaties in substraatgebonden en ongebonden enzymvormen (Fig. 3E (ii)) 29,30,31 en Fig. 3E (iii) β 1-4 galactosyltransferase, PDB-code: 2FYD en 2FY7) 32. De lijn in SeHAS zal waarschijnlijk positionering van SSE8 voor katalyse vergemakkelijken. Residu Gln-248 ligt weg van de bindingszak; de exacte rol van dit residu kon op basis van deze in-silico studies niet worden voorspeld. Interne mutatiestudies tonen aan dat dit residu belangrijk is. Vervanging van het residu door Ala leidt tot bijna volledig verlies van HA productie (Fig. 4A).De rol van dit residu wordt verder onderzocht door middel van grofkorrelige dynamische studies en wordt besproken in een later hoofdstuk.
SSE ‘ s vertonen gecoördineerde beweging
het huidige paradigma is structure-encodes-dynamics-encodes-function33,34,35. Het wordt steeds meer erkend dat willekeurige schommelingen van atomen in hun inheemse staat gecoördineerde beweging verbergen die de proteã ne predisponeren voor functioneel relevante veranderingen in structuur. Deze bewegingen kunnen worden vastgelegd door laagfrequente modi in elastische netwerkmodellering. Deze modi staan bekend als ongevoelig voor structurele en energetische details. Daarom gebruikten we Anisotropic Network Modeling (ANM), een op ENM gebaseerde aanpak om een globaal beeld te krijgen van dynamica gecodeerd door 3D-structuur van SeHAS. We gebruikten ProDy36 voor ANM-berekeningen. Verdere details worden uitgewerkt in de sectie methoden. Gecoördineerde beweging wordt weergegeven als correlatiecoëfficiënt waarden tussen knooppunten van het ANM-netwerk. De gemiddelde waarden van de correlatiecoëfficiënt werden berekend op basis van de eerste 50 modi. Figuur 5A toont de correlatiekaart voor SeHAS. Positieve correlatiecoëfficiënt waarden zijn indicatief voor atomen bewegen in dezelfde richting. Cluster van ruimtelijk proximale residuen met een hoge correlatiecoëfficiënt worden beschouwd als structureel en functioneel belangrijk. De residuparen met grote positieve waarden komen overeen met substructurele elementen. Verder strekt de correlatie tussen residuparen zich uit tot gebieden over verschillende SSE. SSE1-4 vormen een nauw interactief subdomein (zwarte rechthoek). Op dezelfde manier vormen SSE5-9 een gecoördineerd interactief subdomein (grijze rechthoek). De twee subdomeinen worden gescheiden door een slecht gecorreleerde regio. De intrinsieke globale bewegingen illustreren de vereiste functionele coördinatie met betrekking tot substraatbinding aan het ene uiteinde, door SSE1-4 en polymeerbinding aan het andere uiteinde (SSE5-9).

beoordeling van de mondiale dynamiek in SeHAS. (A) gemiddelde waarden van de correlatiecoëfficiënt voor SeHAS voor residuparen. Gemiddelde waarden van de correlatiecoëfficiënt voor Gln-248 (B) en Thr-283 (C) met andere SeHAS-residuen.
we onderzochten verder de dynamiek van SeHAS met betrekking tot residu Gln-248. Fig. 5B geeft de verdeling van de correlatiecoëfficiënt waarden ten opzichte van andere residuen in SeHAS. De Gln-248 toont grote positieve waarden met SSE8, 9 en SSE3 die katalytische en substraatbindingsresten bevatten. Een gecoördineerde beweging met deze SSE ‘ s beoordeeld door ANM illustreert verder zijn rol in functioneel relevante bouwdynamiek.
het ANM-onderzoek wordt uitgebreid om het effect van mutatie op de correlatiecoëfficiënt-waarden te beoordelen. Voor elk van de mutanten wordt een structureel model verkregen met behulp van RaptorX26. De mutanten vertonen een hoge structurele overlap met een gemiddelde RMSD van ongeveer 1 Å over alle atomen met betrekking tot de WT-eiwitstructuur. Voor elke mutantstructuur worden correlatiecoëfficiënt-waarden met betrekking tot mutantresidu berekend en vergeleken met het gew. De percelen zijn weergegeven in Fig. S2. Mutaties op de plaats 214, 248 en 283 vertonen een aanzienlijk verschil in waarden in SSE-regio ‘ s.
reducerende eindpolymeer elongatie in SeHAS, een plausibel driestapsmechanisme
in prototypische leden van de glycosyltransferasefamilie GT-2 zoals cellulosesynthase,vindt de polymeerbiosynthese plaats vanaf het niet-reducerende einde van groeiende polymer25, 31. In dergelijke systemen fungeren UDP-substraten als donor die de suiker overbrengen naar de polymere suiker die als acceptor fungeert24. Een β-koppeling tussen de suikers wordt gecreëerd uit α-gekoppelde suiker-UDP precursoren door een directe verdringings-SN2-substitutiereactie. In deze reactie, functionaliseert een deprotonatiestap door een katalytische basis de acceptor24. Nucleofiele aanval door deze acceptorsuikergroep op de donor via een enkele oxocarbenium ion-like overgangstoestand resulteert in glycosyl overdracht reactie met de afgifte van UDP uit de donorsuiker en netto inversie van stereochemie bij anomerische koolstof. Dit mechanisme wordt geïllustreerd in Fig. 6A. SeHAS verschilt van dit prototype. Het is bekend dat HA uitrekent vanaf het reductiepunt12. Dit houdt in dat (i) UDP vrijkomt uit het polymeereinde en geen UDP-substraten tijdens de katalyse en (ii) omkering van donor en acceptoren met HA-UDP als donor en UDP-suiker substraat als acceptor. Op basis van het landschap van ligand-binding en verkregen kennis over actieve sitearchitectuur, bespreken we de deelname van liganden als donor en acceptor en stellen we een katalytisch mechanisme voor glycosyl transfer in SeHAS voor (zie Fig. 6B).
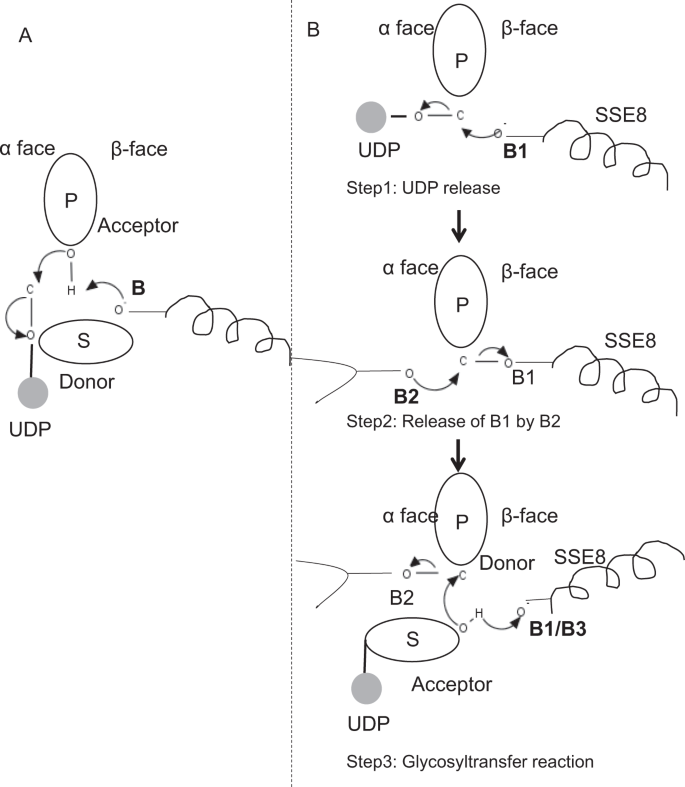
voorgesteld moleculair mechanisme in SeHAS. (A) mechanisme in een prototypische glycosyltransferase met inversiechemie. B)voorgesteld mechanisme in klasse I heeft. P: polymere suiker, S: Substraatsuiker.UDP wordt aangeduid als een cirkel. B1, B2 en B3 zijn de katalytische basen die deelnemen aan het reactiemechanisme.
Glycosyltransferasereactie treedt waarschijnlijk op in meerdere stappen
als eerste stap hebben we de mogelijkheid onderzocht van een enkele stap glycosyltransferasereactie op cellulosesynthase-achtige wijze. Als de glycosyltransferasereactie in één stap voorkomt, zou het enzym op een gegeven moment twee UDP-delen moeten houden, één in bijlage aan polymeer en andere in bijlage aan inkomend substraat. In het alternatieve scenario met meerdere stappen wordt de UDP van polymeer vrijgegeven voordat de katalytische reactie optreedt. In dit geval, om netto inversie van stereochemie te creëren, zou de reactie plaatsvinden in een reeks van oneven aantal stappen met SN2 mechanisme. Om te evalueren welk scenario waarschijnlijker is, hebben we UDP-bindingstudies uitgevoerd door UDP-moleculen in het glycosyltransferase-domein te dokken. De beoordeling wijst op een significante overlapping van UDP-en UDP-substraatbindingsplaatsen.Het resultaat is opgenomen in de aanvullende paragraaf. Een voorbeeldige energetisch gunstige conformatie van UDP samen met substraat en polymeerbindende gebieden zijn weergegeven in aanvullende Fig. S3. Hoewel de beoordeling op het statische model is gebaseerd, is de plaatsing van twee grote molecules van gelijkaardige chemische aard in dichte nabijheid met vereisten van gelijkaardige fysiochemische milieu ‘ s onwaarschijnlijk voor dit enzym. We speculeren dat een passage bekleed met positief geladen residuen van SSE9 en metaalion UDP vrijlating uit het polymeer einde zou kunnen vergemakkelijken. De betrokkenheid van metaalion in glycosyltransferase voor UDP-afgifte is ook goed gedocumenteerd 24. Aangezien de twee UDP-sites elkaar niet uitsluiten, lijkt het tweede scenario van multi-stap reactie waarschijnlijker.
zodra UDP uit polymeer vrijkomt, zou een nucleofiele aanval van de OH–groep substraat-UDP (acceptor) een glycosideverbinding creëren. Om inversie te creëren, moet UDP-vrijgave en daaropvolgende nucleofiele aanval plaatsvinden van twee tegenover elkaar liggende zijden van polymere suiker. Wij stellen de rol voor van drie basiskatalysatoren in het algemene reactieschema die op α-En β-zijden van de donorsuiker aan het polymeereinde liggen. Deze stappen worden geïllustreerd door Fig. 6B en hieronder beschreven.
voorgestelde drie-stappen glycosyltransferasereactie
Stap1: UDP-afgifte: Asp-260 van SSE8 zou als base (B1) kunnen werken en de afgifte van UDP-molecuul uit polymeer (donor) van α-face in gang kunnen zetten. Deze stap zou leiden tot een covalent gebonden glycosyl enzyme intermediair afgeschermd op β gezicht met de basis B1. Om een inversie te creëren moet dit gezicht van de suiker vrij zijn voor nucleofiele aanval door inkomende suiker O-H-Groep. Vandaar dat een tussenstap, met de nucleofiele aanval van α pijler, de β pijler vrijmaakt die klaar is voor nucleofiele aanval door acceptorsuiker.
Stap 2: vrijgave van B1 door B2; onderzoek naar de rol van Thr-283: Base B2 op α gezicht van donorsuiker zou een nucleofiele aanval op de anomerische koolstof in het reactiecentrum uitvoeren en B1 vrijgeven. Onze structurele studies tonen behouden Gln-295 en Thr-283 op deze pijler. UDP-afgifte kan leiden tot conformationele veranderingen en een van deze residuen in de nabijheid van donorsuiker brengen voor katalyse. De mutatie van Gln-295 resulteert in tot 90% verlies van activiteit maar de rol als basis is niet bekend20. We beoordeelden de mogelijkheid van een behouden Thr-283 die in een lus verblijft om als tweede basis te functioneren. We muteerden Thr naar Ser met een soortgelijke functionele OH groep en naar Ala met een kleine alifatische zijketen. Zowel t283a als t283s mutanten vertonen ~ 95% verlies van HA productie (Fig. 4A). Dit residu vertoont een positieve correlatie met de gebieden SSE4 en SSE6 en een ruimtelijk proximaal gebied tussen residu 186 en residu 190 (Fig. 5C). Residu 188, hoewel niet geconserveerd, is in de buurt van gedokt substraat (Fig. 3). Thr-283 toont geen hoge positieve correlatie met SSE8 die de katalytische basis houdt. Het is mogelijk dat het residu tijdens de katalytische reactie fungeert als een ondersteunend basisresidu, waarbij de beweging wordt gecoördineerd met het ruimtelijk proximale substraatbindingsgebied dat onafhankelijk is van de ASP-260-base in SSE8. Verdere experimenten zouden nodig zijn om zijn rol als basis te onderbouwen. In het algemeen wijst de studie op nog een ander functioneel kritisch residu, dat voorheen niet bekend was.
Stap 3: Glycosyltransferreactie: zodra B1 vrijkomt, wordt het β-oppervlak van de anomere koolstof van de polymere suiker voor de reactie gedeblokkeerd. De deprotonatie van substraat-UDP op hetzelfde gezicht door een derde basis zou tot een nucleofiele groep leiden. Deze stap kan worden geïnitieerd door B1 of een andere Base B3. Asp-259, naast B1 is een hoogst behouden residu in nabijheid van substraat-UDP en zou als B3 kunnen handelen. B1 / B3 ligt echter dichter bij de polymere suiker (donor) zoals besproken in Stap 1. Om deprotonatie te starten, moet B1 in de buurt van acceptorsuiker zijn. Dit zou kunnen worden bereikt door veranderingen in de bevleesdheid van de SSE8, bijgestaan door SSE7. De equivalente helix in cellulosesynthase heeft een katalytische basis en ondergaat gecoördineerde conformationele overgangen voor glycosyltransferasereactie en translocatie. Een nucleofiele aanval van de acceptorsuiker op de anomerische koolstof van de donorsuiker zou een glycosidische verbinding en versie van basis B2 tot stand brengen.