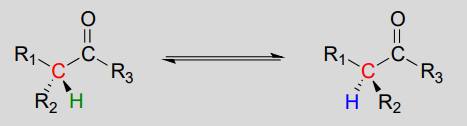
Stereoisomerisering ved \(\alpha\)-carbon
Enolater er et almindeligt mellemprodukt i reaktioner, hvor den stereokemiske konfiguration af et chiralt \(\alpha\)-carbon er interkonverteret. Disse kaldes almindeligvis racemisering eller epimeriseringsreaktioner, afhængigt af om de interkonverterede isomerer er enantiomerer eller epimerer (husk at udtrykket ‘epimer’ henviser til et par diastereomerer, der adskiller sig med et enkelt chiral center).
racemisering / epimerisering:
mekanisme:
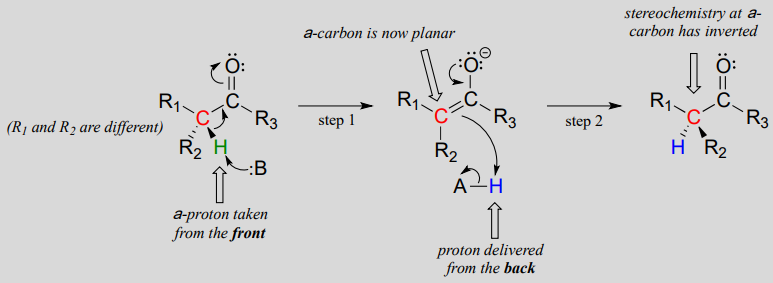
disse reaktioner fortsætter gennem en deprotonation-reprotonation mekanisme, illustreret ovenfor. I trin 1 deprotoneres det chirale a-carbon, hvilket fører til et plan, achiral enolat. I trin 2 leveres en proton tilbage til a-carbonet, men fra den modsatte side, hvorfra protonen blev taget i trin 1, hvilket resulterer i den modsatte stereokemi ved dette kulstof. To syrebasegrupper, der er placeret på modsatte sider af det aktive sted, arbejder sammen for at opnå denne bedrift.
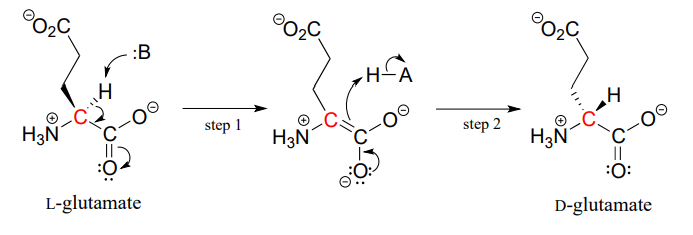
proteinerne og peptiderne i alle kendte levende ting er konstrueret næsten udelukkende af L-aminosyrer, men i sjældne tilfælde har forskere identificeret peptider, der inkorporerer D-aminosyrer, som har den modsatte stereokemi ved a-carbon. Aminosyrer katalyserer interkonverteringen af L-og D-aminosyrer. Som du måske husker fra det indledende afsnit til dette kapitel, indeholder giften af den mandlige platypus et neurotoksisk peptid, hvori en L-leucin aminosyre er blevet omdannet af en racemase til D-leucin. I et andet eksempel er cellevæggene af bakterier konstrueret i en del af peptider indeholdende D-glutamat, konverteret fra L-glutamat af glutamat racemase. (EF 5.1.1.3) (biokemi 2001, 40, 6199).
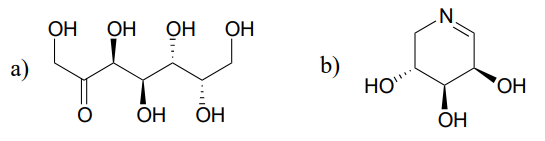
en reaktion (EC 5.1.3.1) i sukkermetabolismen involverer interkonvertering af epimerne ribulose-5-phosphat og ksylulose-5-phosphat. Denne reaktion kaldes en ‘epimerase’. (J. Mol. Biol. 2003, 326, 127).

øvelse \(\Sideindeks{2}\)
Tegn en rimelig mekanisme til ribulose-5-phosphatepimeriseringsreaktionen ovenfor. Din mekanisme skal vise et enolat mellemprodukt og specificere stereokemi overalt.
øvelse \(\Sideindeks{3}\)
Forudsig produkterne af epimeriseringsreaktioner, der starter med hvert af de viste substrater.
tip
carbonatomer ved siden af imine grupper kan også betragtes som \(\alpha\)-carbonatomer!
Husk fra kapitel 3, at et stort problem med lægemidlet thalidomid er det faktum, at R enantiomeren, som er et effektivt beroligende middel, hurtigt isomeriserer i kroppen til den terotogene (mutationsfremkaldende) S enantiomer. Bemærk, at chiral center i thalidomid er en \(\alpha\)-carbon!
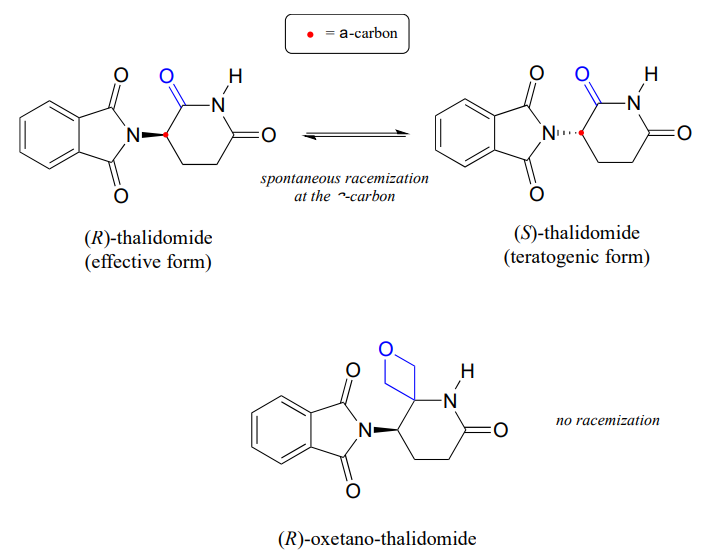
for nylig rapporterede kemikere syntesen af et thalidomidderivat, hvor carbonylgruppen erstattes af en’ oksetan ‘ – ring med det formål at fremstille en isotopisk stabil form af lægemidlet (fordi carbonylgruppen er fjernet, er racemisering ikke længere mulig-der er ikke noget A-kulstof!) (Org. LETT. 2013, 15, 4312.)