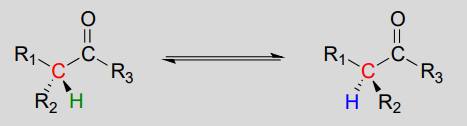
Stereoisomerisering ved \(\alpha\) – karbon
Enolater er et vanlig mellomprodukt i reaksjoner der den stereokjemiske konfigurasjonen av et kiralt\(\alpha\)-karbon er interkonvertert. Disse blir ofte referert til som racemisering eller epimerizasjonsreaksjoner, avhengig av om de interkonverterte isomerer er enantiomerer eller epimerer (husk at begrepet ‘epimer’ refererer til et par diastereomerer som avviker fra et enkelt kiralt senter).
Racemisering / epimerisering:
Mekanisme:
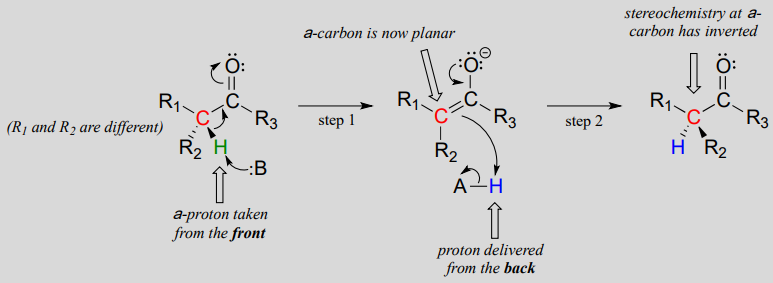
disse reaksjonene fortsetter gjennom en deprotonasjon-reprotonasjonsmekanisme, illustrert ovenfor. I trinn 1 blir det kirale a-karbon deprotonert, noe som fører til en plan, achiral enolat. I trinn 2 leveres et proton tilbake til a-karbonet, men fra motsatt side hvorfra protonet ble tatt i trinn 1, noe som resulterte i motsatt stereokjemi ved dette karbonet. To syrebasegrupper, plassert på motsatte sider av enzymets aktive sted, jobber sammen for å oppnå denne prestasjonen.
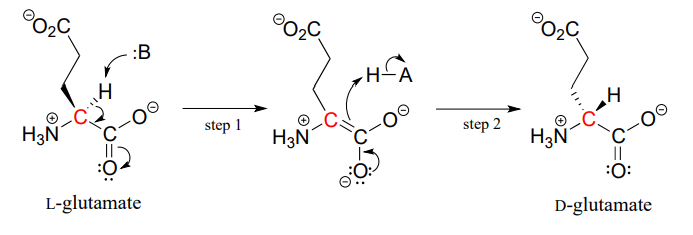
proteiner og peptider i alle kjente levende ting er konstruert nesten utelukkende Av l-aminosyrer, men i sjeldne tilfeller har forskere identifisert peptider som inneholder D-aminosyrer, som har motsatt stereokjemi ved a-karbon. Aminosyre racemase enzymer katalyserer interkonvertering Av l og d aminosyrer. Som du kanskje husker fra innledningen til dette kapitlet, inneholder giftet til den mannlige platypus et nevrotoksisk peptid der En l-leucinaminosyre er omdannet av et racemase-enzym Til d-leucin. I et annet eksempel er celleveggene av bakterier konstruert i en del av peptider som inneholder d-glutamat, omdannet Fra L-glutamat av enzymet glutamat racemase. (EF 5.1.1.3) (Biokjemi 2001, 40, 6199).
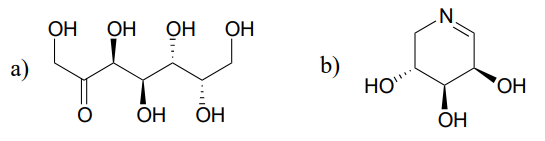
en reaksjon (EC 5.1.3.1) i sukker metabolisme innebærer interkonvertering av epimerer ribulose-5-fosfat og xylulose-5-fosfat. Enzymet som katalyserer denne reaksjonen kalles en epimerase. (J. Mol. Biol. 2003, 326, 127).

Øvelse \(\PageIndex{2}\)
Tegn en rimelig mekanisme for ribulose-5-fosfat epimerizasjonsreaksjonen ovenfor. Din mekanisme skal vise et enolat mellomprodukt og spesifisere stereokjemi gjennom hele.
Øvelse \(\PageIndex{3}\)
Forutsi produktene av epimerizasjonsreaksjoner som starter med hvert av de viste substratene.
Hint
Karboner ved siden av imine-grupper kan også betraktes som \(\alpha\) – karboner!
Husk fra kapittel 3 at et stort problem med stoffet thalidomid er det faktum At R enantiomeren, som er et effektivt beroligende middel, raskt isomeriserer i kroppen til den terotogene (mutasjonsfremkallende) s enantiomeren. Merk at det kirale senteret i thalidomid er et\(\alfa\)-karbon!
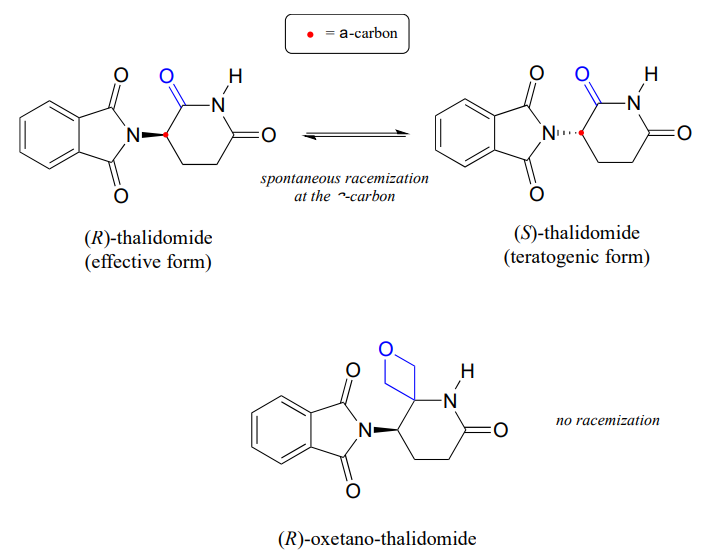
nylig rapporterte kjemikere syntesen av et thalidomidderivat der karbonylgruppen erstattes av en’ oksetan ‘ – ring, med sikte på å lage en isotopisk stabil form av stoffet (fordi karbonylgruppen er fjernet, er racemisering ikke lenger mulig-det er ikke noe a-karbon!) (Org. Lett. 2013, 15, 4312.)