Stereoisomerizzazione al \(\alpha\)-carbon
Gli enolati sono un intermedio comune nelle reazioni in cui la configurazione stereochimica di un chirale \(\alpha\)-carbon è interconvertito. Questi sono comunemente indicati come reazioni di racemizzazione o epimerizzazione, a seconda che gli isomeri interconvertiti siano enantiomeri o epimeri (ricordiamo che il termine “epimero” si riferisce a una coppia di diastereomeri che differiscono da un singolo centro chirale).
Racemizzazione / epimerizzazione:
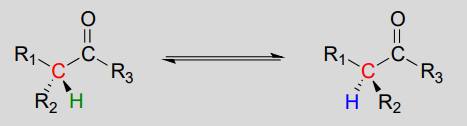
Meccanismo:
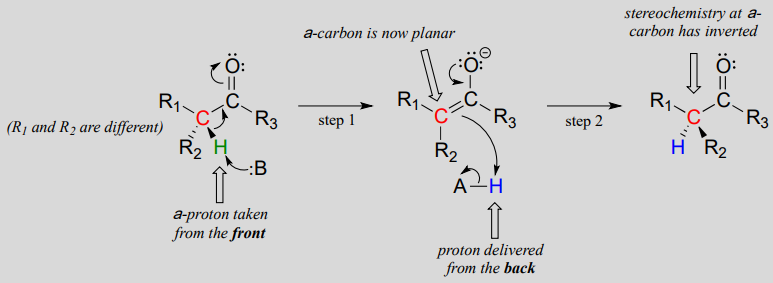
Queste reazioni procedono attraverso un meccanismo di deprotonazione-riprotonazione, illustrato sopra. Nella fase 1, l’a-carbonio chirale è deprotonato, portando ad un enolato achirale planare. Nella fase 2, un protone viene consegnato di nuovo al carbonio a, ma dal lato opposto da cui il protone è stato preso nella fase 1, con conseguente stereochimica opposta a questo carbonio. Due gruppi acido-base, posizionati ai lati opposti del sito attivo dell’enzima, lavorano in tandem per compiere questa impresa.
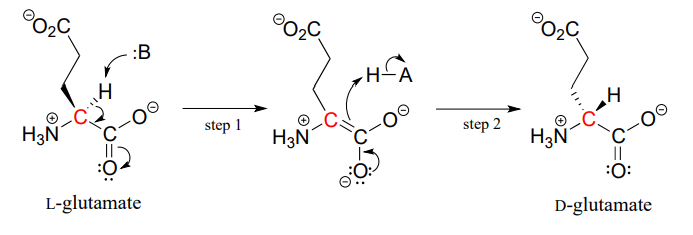
Le proteine e i peptidi in tutti gli esseri viventi conosciuti sono costruiti quasi esclusivamente di aminoacidi L, ma in rari casi gli scienziati hanno identificato peptidi che incorporano aminoacidi D, che hanno la stereochimica opposta al carbonio A. Gli enzimi della racemasi dell’aminoacido catalizzano l’interconversione degli aminoacidi L e D. Come si può ricordare dalla sezione introduttiva a questo capitolo, il veleno dell’ornitorinco maschio contiene un peptide neurotossico in cui un amminoacido L-leucina è stato convertito da un enzima racemasi in D-leucina. In un altro esempio, le pareti cellulari dei batteri sono costruite in parte di peptidi contenenti D-glutammato, convertiti da L-glutammato dall’enzima glutammato racemasi. (CE 5.1.1.3) (Biochimica 2001, 40, 6199).
Una reazione (EC 5.1.3.1) nel metabolismo degli zuccheri comporta l’interconversione degli epimeri ribulosio-5-fosfato e xilulosio-5-fosfato. L’enzima che catalizza questa reazione è chiamato “epimerasi”. (J. Mol. Biol. 2003, 326, 127).

Esercizio \(\PageIndex{2}\)
Disegnare un meccanismo ragionevole per la reazione di epimerizzazione ribulosio-5-fosfato sopra. Il tuo meccanismo dovrebbe mostrare un intermedio enolato e specificare la stereochimica in tutto.
Esercizio \(\PageIndex{3}\)
Predire i prodotti delle reazioni di epimerizzazione a partire da ciascuno dei substrati mostrati.
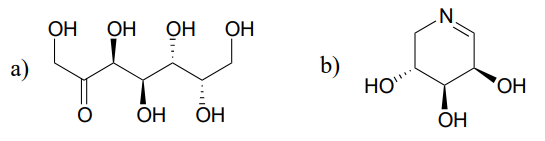
Suggerimento
I carboni accanto ai gruppi immini possono anche essere considerati\(\alpha\)-carboni!
Ricordiamo dal capitolo 3 che un problema importante con il farmaco talidomide è il fatto che l’enantiomero R, che è un sedativo efficace, isomerizza rapidamente nel corpo all’enantiomero S terotogeno (che causa la mutazione). Si noti che il centro chirale in talidomide è un carbonio \ (\alfa\)!
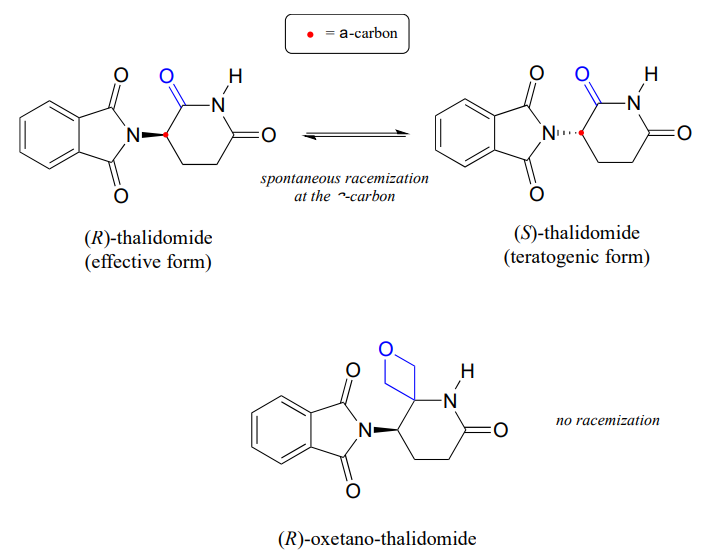
Recentemente chimici riportato la sintesi di un talidomide derivati in cui il gruppo carbonilico è sostituito da un ‘oxetane’ anello, con l’obiettivo di rendere un isotopi stabili forma del farmaco (perché il gruppo carbonilico è stato rimosso, racemizzazione non è più possibile, non c’è un tenore di carbonio!) (Org. Lett. 2013, 15, 4312.)