Stereoisomerisierung am \ (\alpha\)-Kohlenstoff
Enolate sind ein häufiges Zwischenprodukt in Reaktionen, bei denen die stereochemische Konfiguration eines chiralen \ (\alpha\) -Kohlenstoffs interkonvertiert wird. Diese werden üblicherweise als Racemisierungs- oder Epimerisierungsreaktionen bezeichnet, je nachdem, ob es sich bei den interkonvertierten Isomeren um Enantiomere oder Epimere handelt (denken Sie daran, dass sich der Begriff Epimer auf ein Paar Diastereomere bezieht, die sich durch ein einzelnes chirales Zentrum unterscheiden).
Racemisierung/ Epimerisierung:
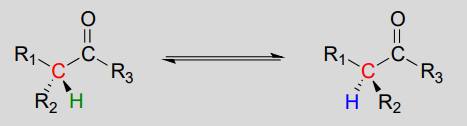
Mechanismus:
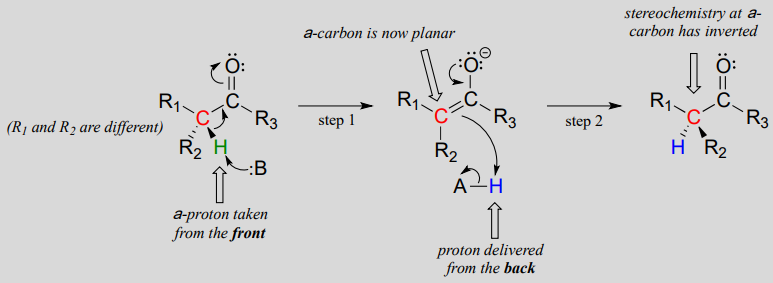
Diese Reaktionen verlaufen durch einen Deprotonierungs-Reprotonierungsmechanismus, der oben dargestellt ist. In Schritt 1 wird der chirale a-Kohlenstoff deprotoniert, was zu einem planaren, achiralen Enolat führt. In Schritt 2 wird ein Proton zurück an den a-Kohlenstoff abgegeben, jedoch von der gegenüberliegenden Seite, von der das Proton in Schritt 1 entnommen wurde, was zu der entgegengesetzten Stereochemie an diesem Kohlenstoff führt. Zwei Säure-Base-Gruppen, die an gegenüberliegenden Seiten des aktiven Zentrums des Enzyms positioniert sind, arbeiten zusammen, um dieses Kunststück zu vollbringen.
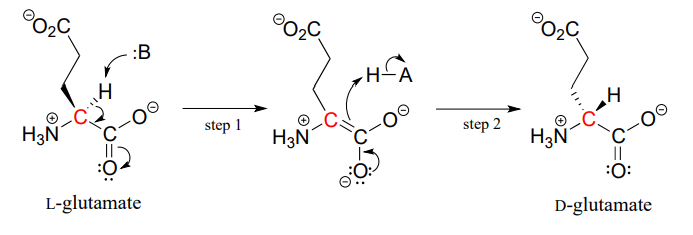
Die Proteine und Peptide in allen bekannten Lebewesen bestehen fast ausschließlich aus L-Aminosäuren, aber in seltenen Fällen haben Wissenschaftler Peptide identifiziert, die D-Aminosäuren enthalten, die am a-Kohlenstoff die entgegengesetzte Stereochemie aufweisen. Aminosäure-Racemase-Enzyme katalysieren die Umwandlung von L- und D-Aminosäuren. Wie Sie sich vielleicht aus dem einleitenden Abschnitt dieses Kapitels erinnern, enthält das Gift des männlichen Schnabeltiers ein neurotoxisches Peptid, in dem eine L-Leucin-Aminosäure durch ein Racemase-Enzym in D-Leucin umgewandelt wurde. In einem anderen Beispiel sind die Zellwände von Bakterien teilweise aus Peptiden aufgebaut, die D-Glutamat enthalten, das durch das Enzym Glutamat-Racemase aus L-Glutamat umgewandelt wird. (EG 5.1.1.3) (Biochemistry 2001, 40, 6199).
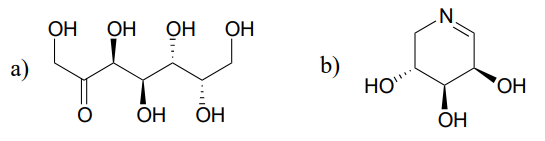
Eine Reaktion (EC 5.1.3.1) im Zuckerstoffwechsel beinhaltet die Umwandlung der Epimere Ribulose-5-phosphat und Xylulose-5-phosphat. Das Enzym, das diese Reaktion katalysiert, wird Epimerase genannt. In: J. Mol. Biol. 2003, 326, 127).

Übung \(\pageIndex{2}\)
Zeichnen Sie oben einen vernünftigen Mechanismus für die Ribulose-5-phosphat-Epimerisationsreaktion. Ihr Mechanismus sollte ein Enolat-Intermediat aufweisen und die Stereochemie durchgehend angeben.
Übung \(\pageIndex{3}\)
Vorhersage der Produkte von Epimerisierungsreaktionen, beginnend mit jedem der gezeigten Substrate.
Hinweis
Kohlenstoffe neben Imingruppen können auch als \(\alpha\)-Kohlenstoffe betrachtet werden!
Erinnern Sie sich aus Kapitel 3 daran, dass ein Hauptproblem bei dem Arzneimittel Thalidomid die Tatsache ist, dass das R-Enantiomer, das ein wirksames Beruhigungsmittel ist, im Körper schnell zu dem terotogenen (mutationsverursachenden) S-Enantiomer isomerisiert. Beachten Sie, dass das chirale Zentrum in Thalidomid ein \ (\alpha\) -Kohlenstoff ist!
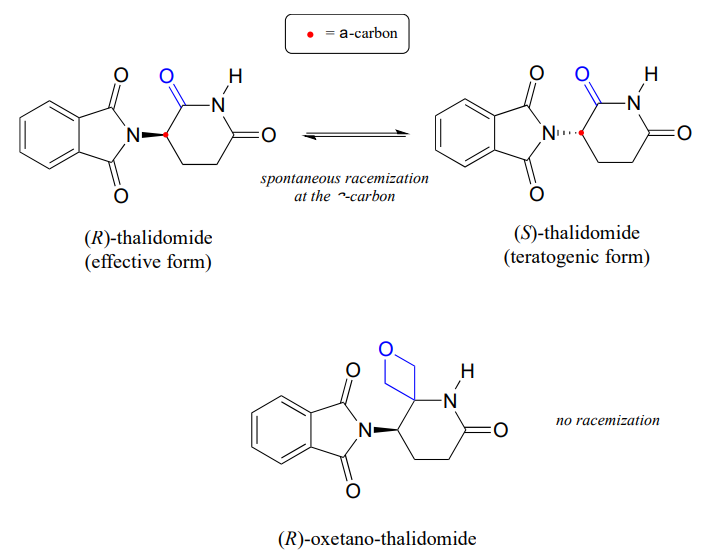
Kürzlich berichteten Chemiker über die Synthese eines Thalidomidderivats, bei dem die Carbonylgruppe durch einen Oxetanring ersetzt wird, mit dem Ziel, eine isotopisch stabile Form des Arzneimittels herzustellen (da die Carbonylgruppe entfernt wurde, ist eine Racemisierung nicht mehr möglich – es gibt keinen A-Kohlenstoff!) (Organisierungstafel. Lett. 2013, 15, 4312.)