Stéréoisomérisation au niveau du carbone \(\alpha\)
Les énolates sont un intermédiaire courant dans les réactions où la configuration stéréochimique d’un carbone chiral \(\alpha\) est interconvertie. Celles-ci sont communément appelées réactions de racémisation ou d’épimérisation, selon que les isomères interconvertis sont des énantiomères ou des épimères (rappelons que le terme » épimère » désigne une paire de diastéréomères qui diffèrent par un seul centre chiral).
Racémisation / épimérisation:
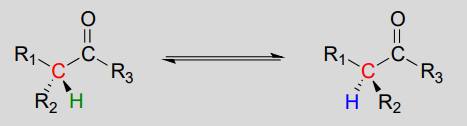
Mécanisme:
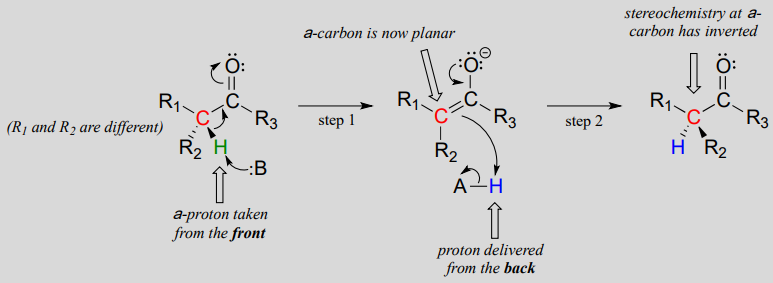
Ces réactions se déroulent par un mécanisme de déprotonation-reprotonation, illustré ci-dessus. À l’étape 1, le carbone a chiral est déprotoné, conduisant à un énolate achiral planaire. À l’étape 2, un proton est renvoyé au carbone a, mais du côté opposé à partir duquel le proton a été prélevé à l’étape 1, ce qui entraîne la stéréochimie opposée à ce carbone. Deux groupes acide-base, positionnés de part et d’autre du site actif de l’enzyme, travaillent en tandem pour accomplir cet exploit.
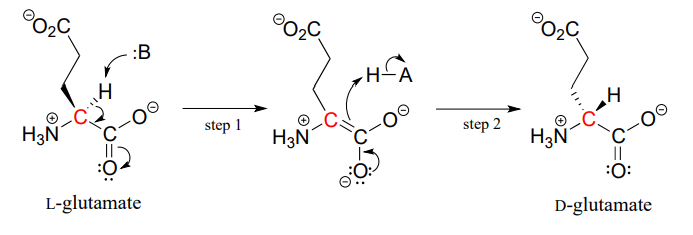
Les protéines et les peptides de tous les êtres vivants connus sont construits presque exclusivement à partir d’acides aminés L, mais dans de rares cas, les scientifiques ont identifié des peptides qui incorporent des acides aminés D, qui ont la stéréochimie opposée au carbone a. Les enzymes racémases d’acides aminés catalysent l’interconversion des acides aminés L et D. Comme vous vous en souvenez peut-être dans la section introductive de ce chapitre, le venin de l’ornithorynque mâle contient un peptide neurotoxique dans lequel un acide aminé L-leucine a été converti par une enzyme racémase en D-leucine. Dans un autre example, les parois cellulaires des bactéries sont construites en partie à partir de peptides contenant du D-glutamate, convertis à partir du L-glutamate par l’enzyme glutamate racémase. (CE 5.1.1.3) (Biochimie 2001, 40, 6199).
Une réaction (EC 5.1.3.1) dans le métabolisme du sucre implique l’interconversion des épimères ribulose-5-phosphate et xylulose-5-phosphate. L’enzyme qui catalyse cette réaction est appelée » épimérase « . (J. Mol. Biol. 2003, 326, 127).

Exercice \(\PageIndex{2}\)
Dessinez un mécanisme raisonnable pour la réaction d’épimérisation du ribulose-5-phosphate ci-dessus. Votre mécanisme doit montrer un intermédiaire énolate et spécifier la stéréochimie tout au long.
Exercice \(\PageIndex{3}\)
Prédire les produits des réactions d’épimérisation à partir de chacun des substrats représentés.
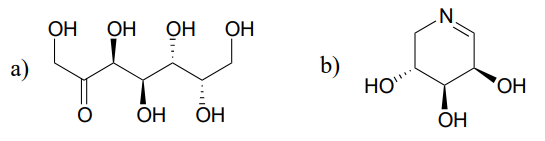
Indice
Les carbones à côté des groupes imines peuvent également être considérés comme des \(\alpha\) -carbones!
Rappelons du chapitre 3 qu’un problème majeur avec le médicament thalidomide est le fait que l’énantiomère R, qui est un sédatif efficace, s’isomérise rapidement dans l’organisme en énantiomère S terotogène (provoquant des mutations). Notez que le centre chiral de la thalidomide est un \(\alpha\)-carbone!
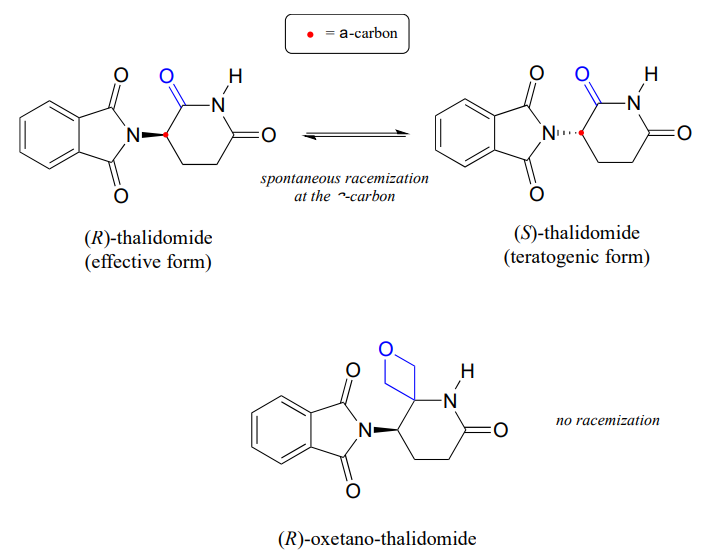
Récemment, des chimistes ont rapporté la synthèse d’un dérivé de la thalidomide dans lequel le groupe carbonyle est remplacé par un cycle « oxétane », dans le but de rendre une forme isotopiquement stable du médicament (le groupe carbonyle ayant été supprimé, la racémisation n’est plus possible – il n’y a pas de carbone a!) (Org. Lett. 2013, 15, 4312.)