\(\alpha\)-炭素での立体異性化
エノラートは、キラルな\(\alpha\)-炭素の立体化学的配置が相互変換される反応における一般的な中間体である。 これらは一般に、相互変換された異性体が鏡像異性体またはエピマーであるかどうかに応じて、ラセミ化またはエピマー化反応と呼ばれる(”エピマー”という用語は、単一のキラル中心によって異なる一対のジアステレオマーを指すことを思い出してください)。
ラセミ化/エピメリゼーション:
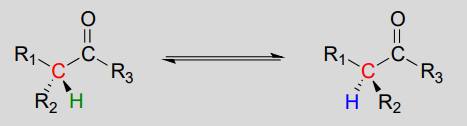
メカニズム:
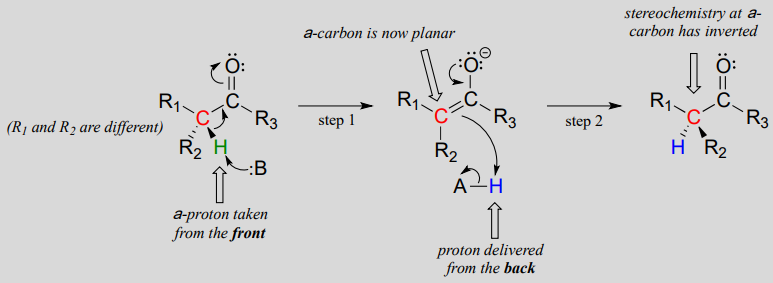
これらの反応は、上に示した脱プロトン化-再プロトン化機構を介して進行する。 ステップ1では、キラルa-炭素が脱プロトン化され、平面のアキラルエノラートが得られる。 ステップ2では、プロトンがa炭素に戻って送達されるが、ステップ1でプロトンが取り込まれた反対側から、この炭素で反対の立体化学が生じる。 この酵素の活性部位の反対側に位置する二つの酸塩基基は、この偉業を達成するために並行して働く。
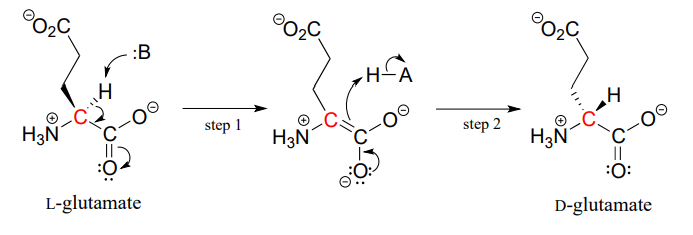
すべての既知の生物のタンパク質とペプチドは、ほぼ排他的にL-アミノ酸から構築されていますが、まれに科学者たちは、a-炭素で反対の立体化学を アミノ酸ラセマーゼの酵素はLおよびDのアミノ酸の相互変換に触媒作用を及ぼします。 あなたはこの章に入門セクションから思い出すことができるように、男性カモノハシの毒は、L-ロイシンアミノ酸がD-ロイシンにラセマーゼ酵素に 別の例では、細菌の細胞壁は、酵素グルタミン酸ラセマーゼによってL−グルタミン酸から変換された、D−グルタミン酸を含有するペプチドの一部に構 3)(Biochemistry2 0 0 1,4 0,6 1 9 9)。
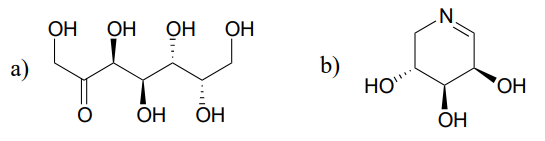
糖代謝における反応(EC5.1.3.1)は、エピマーリブロース-5-リン酸とキシルロース-5-リン酸の相互変換を伴う。 この反応を触媒する酵素は”エピメラーゼ”と呼ばれる。 (J.Mol. バイオル 2003, 326, 127).

運動\(\PageIndex{2}\)
上記のリブロース-5-リン酸エピマー化反応のための合理的なメカニズムを描画します。 あなたのメカニズムは、エノラート中間体を示し、全体の立体化学を指定する必要があります。
運動\(\PageIndex{3}\)
示されている各基質から始まるエピマー化反応の生成物を予測する。
ヒント
イミン基の隣の炭素も\(\alpha\)-炭素と考えることができます!
薬物サリドマイドの主な問題は、効果的な鎮静剤であるR鏡像異性体が体内でテロトゲン(変異を引き起こす)S鏡像異性体に急速に異性化することであることを第3章から思い出してください。 サリドマイド中のキラル中心は\(\alpha\)-炭素であることに注意してください。
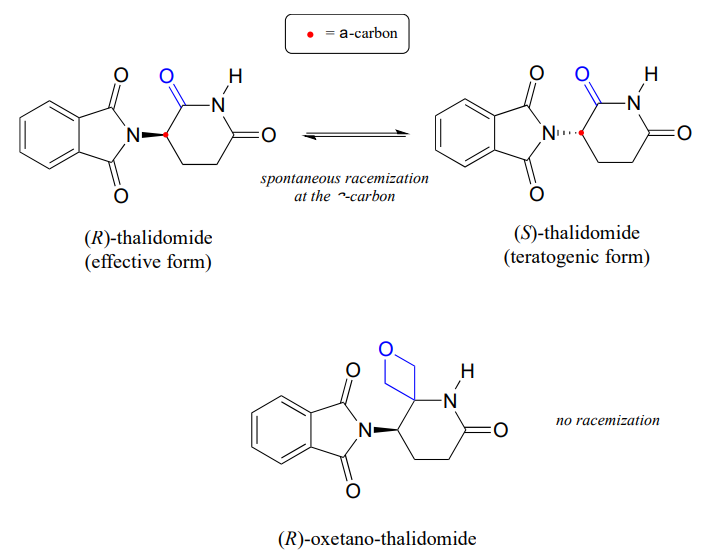
最近、化学者は、カルボニル基が”オキセタン”環に置き換えられたサリドマイド誘導体の合成を報告し、同位体的に安定な形態の薬物を作ることを目的としている(カルボニル基が除去されているため、ラセミ化はもはや不可能である-a-炭素は存在しない!)(組織… レット 2013, 15, 4312.)