Stereoizomeryzacja przy \(\alpha\)-węgiel
Enolany są powszechnym związkiem pośrednim w reakcjach, w których stereochemiczna konfiguracja chiralnego \(\alpha\)-węgiel jest interkonwertowana. Są one powszechnie określane jako racemizacja lub reakcje epimeryzacji, w zależności od tego, czy izomery interkonwertowane są enancjomerami, czy epimerami (przypomnijmy, że termin „epimer” odnosi się do pary diastereomerów, które różnią się pojedynczym centrum chiralnym).
Racemizacja / epimeryzacja:
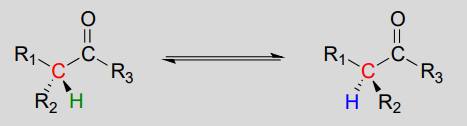
Mechanizm:
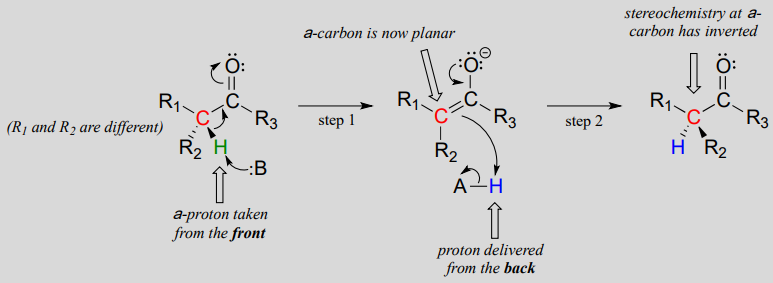
reakcje te przebiegają za pomocą mechanizmu deprotonacji-reprotonacji, zilustrowanego powyżej. W etapie 1 chiralny węgiel a jest deprotonowany, co prowadzi do płaskiego, achiralnego enolatu. W kroku 2 proton jest dostarczany z powrotem do węgla a, ale z przeciwnej strony, z której Proton został pobrany w kroku 1, co powoduje odwrotną stereochemię tego węgla. Dwie grupy kwasowo-zasadowe, umieszczone po przeciwnych stronach miejsca aktywnego enzymu, działają w tandemie, aby osiągnąć ten wyczyn.
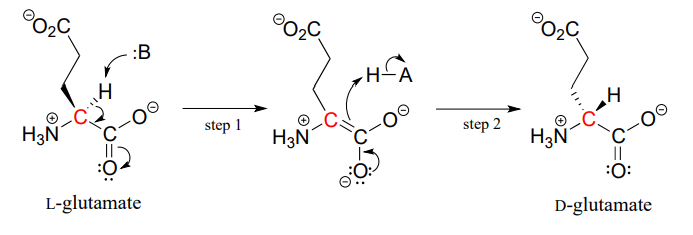
białka i peptydy we wszystkich znanych żywych istotach są zbudowane prawie wyłącznie z L-aminokwasów, ale w rzadkich przypadkach naukowcy zidentyfikowali peptydy, które zawierają d-aminokwasy, które mają przeciwną stereochemię w węglu A. Aminokwasowe enzymy racemazy katalizują interkonwersję aminokwasów L i D. Jak można sobie przypomnieć z części wprowadzającej do tego rozdziału, jad męskiego dziobaka zawiera neurotoksyczny peptyd, w którym aminokwas L-leucyny został przekształcony przez enzym racemazy do D-leucyny. W innym przykładzie ściany komórkowe bakterii zbudowane są w części z peptydów zawierających d-glutaminian, przekształcanych z L-glutaminianu przez enzym racemazę glutaminianową. (EC 5.1.1.3) (Biochemistry 2001, 40, 6199).
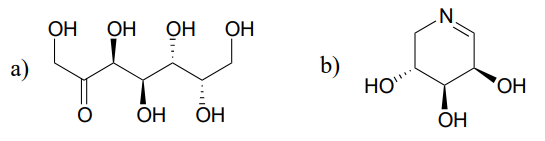
reakcja (EC 5.1.3.1) w metabolizmie cukru obejmuje interkonwersję epimerów rybulozo-5-fosforanu i ksylulozo-5-fosforanu. Enzym katalizujący tę reakcję nazywany jest „epimerazą”. (J. Mol. Biol. 2003, 326, 127).

ćwiczenia \(\PageIndex{2}\)
narysuj rozsądny mechanizm reakcji epimeryzacji rybulozo-5-fosforanu powyżej. Twój mechanizm powinien pokazać enolate pośredni i określić stereochemię w całym.
ćwiczenia \(\PageIndex{3}\)
przewidzieć produkty reakcji epimeryzacji począwszy od każdego z przedstawionych substratów.
podpowiedź
węgle obok grup iminowych można również uznać za \(\alpha\)-węgle!
Przypomnijmy z rozdziału 3, że głównym problemem leku talidomid jest fakt, że enancjomer R, który jest skutecznym środkiem uspokajającym, szybko izomeryzuje się w organizmie do terotogennego (powodującego mutacje) enancjomeru S. Zauważ, że chiralnym ośrodkiem w talidomidzie jest \(\alpha\)-węgiel!
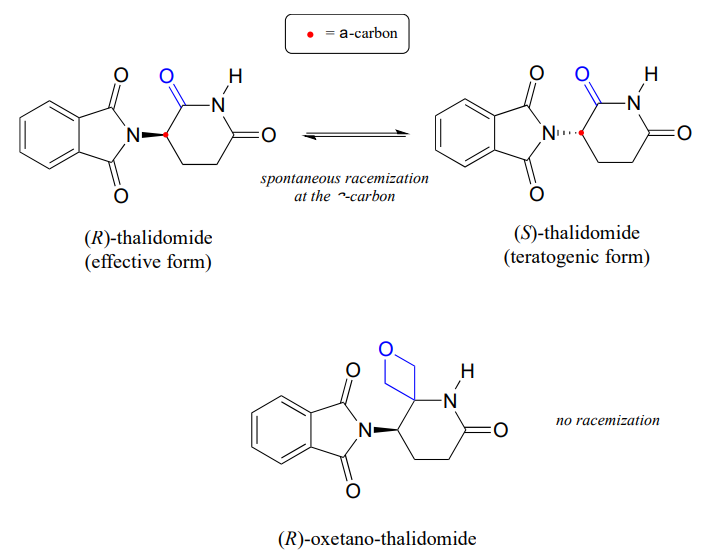
ostatnio chemicy donieśli o syntezie pochodnej talidomidu, w której grupa karbonylowa jest zastąpiona pierścieniem „oksetanowym”, w celu wytworzenia izotopowo stabilnej postaci leku (ponieważ grupa karbonylowa została usunięta, racemizacja nie jest już możliwa – nie ma węgla a!) (Org. Lett. 2013, 15, 4312.)