- caracteristici structurale 3-D ale SeHAS
- elemente Substructurale (SSE) în clasa I are
- locurile de legare ale substraturilor UDP se suprapun
- Lys-139 este dispensabil în SeHAS și are un rol în legarea substratului
- SSE5 se leagă de polimer și influențează producția HA
- Gln-248 (SSE7) este critică cu un rol plauzibil în tranziția conformației
- SS prezintă mișcare coordonată
- reducerea alungirii polimerului final în SeHAS, un mecanism plauzibil în trei etape
- reacția Glicoziltransferazei apare probabil în mai multe etape
- a propus trei etape glicoziltransferază reacție
caracteristici structurale 3-D ale SeHAS
un model structural al secvenței Sehas a fost generat folosind RaptorX webserver26. Modelul a fost obținut cu șablonul de sintază de celuloză (PDB: 4p00).Enzima șablon are o similitudine funcțională ridicată și o similitudine de secvență scăzută (~15%) cu SeHAS25. În ciuda similitudinii slabe a secvenței cu șablonul, modelul obținut este de înaltă calitate, așa cum este indicat de măsurătorile de calitate globale (valoarea P: 10-8) și absolute (scorul GDT: 52) 26. Evaluarea calității Stereo-chimice a modelului structural indică faptul că 98,5% din reziduuri se află în regiunea permisă/parțial permisă a parcelei Ramachandran.
Figura 1 prezintă modelul structural al SeHAS. Modelul structural HAS arată că lanțul unic se pliază în trei componente: (i) un domeniu funcțional de glicoziltransferază, (ii) patru spirale transmembranare (TM1-TM4) și (iii) trei spirale amfipatice (AP1-AP3). Domeniul glicoziltransferazei adoptă pliul GT-a format dintr-o foaie mixtă de 7 catenare, înconjurată de helice de la centuri de siguranță, în arhitectură de la centuri de siguranță. Spiralele transmembranare (TM1-TM4) formează un pachet de patru helix și creează un por pentru translocarea polimerului. 11 Se estimează că reziduurile C-terminale ale SeHAS sunt dezordonate și nu sunt prezentate în Fig. 1. Natura oligomerică a SeHAS este încă investigată. Până în 2018, SeHAS a fost caracterizat să funcționeze în forma sa monomerică9. Rapoartele recente indică funcțiile enzimei SeHAS ca homodimer27. Domeniul de aplicare al prezentei lucrări este limitat la evaluarea caracteristicilor din protomer.

modelul Structural și caracteristicile SeHAS. SSE: element Substructural, AP: Helix Amfipatic, TM: Helix Trans-membrană.
modelul structural 3-D al SeHAS este în concordanță cu topologia determinată anterior A has în Streptococcus pyogenes derivată folosind experimente de fuziune,etichetare și accesibilitate la proteaze12,16, 19 cu o ușoară diferență în numărul de helice amfipatice. Propunem prezența a trei helice amfipatice în loc de două helice amfipatice raportate anterior pe baza evaluării comparative cu structura celuloz sintazei. Reziduurile SeHAS corespunzătoare helixului amfipatic AP2 nu au fost sondate special pentru localizarea lor celulară16. După cum sa discutat mai târziu în acest manuscris, această helix deține reziduuri de importanță funcțională.
modelul structural explică rezultatele inhibării N-etilmaleimidei (NEM) în SeHAS19. Nem reacționează cu grupările tiol și, prin urmare, este utilizat pentru a testa rolul reziduurilor de cisteină în proteine. SeHAS are patru reziduuri Cys: Cys-226, Cys-262 și Cys-281 și Cys-367. Primele trei reziduuri de cisteină sunt localizate în citosol și, prin urmare, sunt accesibile NEM, ducând la inhibare. Cu toate acestea, Cys-367 este situat în spirala transmembranară și este inaccesibil pentru NEM. Prin urmare, nu este raportată nicio inhibare pentru acest reziduu. În prezența substratului, se arată că NEM se leagă numai de Cys-281. Studiile noastre structurale (descrise mai târziu) indică faptul că Cys-226 și Cys-262 sunt situate în imediata apropiere a locului de legare a substratului UDP și prezența substratului ar bloca astfel accesul NEM la aceste reziduuri. Cys-281 se află departe de situsul de legare UDP și prezența substratului nu blochează acest situs de inhibarea NEM.
elemente Substructurale (SSE) în clasa I are
există puține informații despre mașinile funcționale specifice clasei I are. În absența structurii 3-D, nu este cunoscut un rol funcțional al siturilor studiate experimental. Prin urmare, pentru a obține o înțelegere asupra componentelor funcționale din SeHAS și dispunerea lor relativă în 3-D, identificăm regiuni contigue scurte cu caracteristici de secvență conservate evolutiv numite elemente sub-structurale (SSE). Am comparat 81 clasa I are secvențe obținute prin criterii de selecție stricte elaborate în secțiunea Metode. Clasa I are enzime diferă în numărul de spirale transmembranare. În absența informațiilor structurale, alinierea în această regiune este de slabă calitate. Prin urmare, compararea secvențelor este limitată la regiunea citosolică pentru a evita siturile cu corespondență ambiguă reziduuri-reziduuri. Alinierea secvențelor HAS clasa I este prevăzută ca suplimentară Fig. S1, creat cu Jalview. Se calculează un scor de conservare pentru fiecare corespondență reziduu-reziduu în ceea ce privește secvența sehas. O întindere contiguă cu scorul mediu > = 70 și cel puțin 2 site-uri cu scorul > = 80 este definită ca element substructural (SSE). Folosind aceste criterii, identificăm 9 elemente sub-structurale, etichetate SSE1-SSE9, de importanță structurală/funcțională potențială în HAS (Fig. 2). Structura secundară pentru majoritatea hărților SSEs către bucle, cu excepția SSE5, SSE8 și SSE9 care apar în helice. Aceste elemente sunt, de asemenea, marcate în Fig. 1. Tabelul 1 rezumă detaliile secvenței, precum și rolul structural și funcțional al SSE.

un complot de scor de conservare cu privire la numărul de ordine SeHAS. SSE indicat în partea de sus. Proiecția secundară a structurii secvenței este indicată în partea de jos. Lanțurile sunt marcate ca săgeți și helice reprezentate ca dreptunghiuri. Dreptunghiurile umplute corespund helicelor amfipatice. Consultați textul pentru detalii.
rapoartele noastre de studiu au conservat Sse5 și SSE7 specifice HAS. Mutațiile studiate până în prezent, corespunzătoare reziduurilor Tyr-74, Asp-159, Ser-218, Cys-226. Leu-230, Tyr-233, ARG-234, Asp-259, Asp-260, ARG-261, Leu-263, Cys-281, Gln-295, Gln-296, Asn-297, Arg-298, Trp-299, Arg-406, Arg-413, s-au dovedit a influența activitatea. Mutațiile corespunzătoare reziduurilor Lys-48, Glu-327, Lys-414,Lys-415 influențează viteza de reacție și/sau greutatea moleculară a polimerului HA18,19,20,21, 23. Majoritatea acestor site-uri de mutație se mapează la SSE1-4, 6, 8 și 9 (Tabelul 1).Alte site-uri nu sunt o caracteristică conservat de clasa I are familie. Bi și colab. (2015) au analizat diverse glicoziltransferaze procesive și au discutat despre prezența a trei reziduuri Asp distanțate variabil în domeniul glicoziltransferazei, care sunt cruciale pentru activitate25. Acestea includ, Asp de la SSE1 în legarea nucleotidelor, Asp de SSE2 în legarea la metal, Asp în SSE8 cu un rol probabil ca bază. În plus, un rol probabil în legarea polimerilor este sugerat pentru reziduurile SSE9. Weigel (2015) a propus opt tri-Peptide care conțin Asp/Glu ca regiuni potențiale implicate în legarea UDP-zahăr12. Pentru a elucida rolul SSE și a identifica regiunile care se leagă de zaharurile UDP, am efectuat simulări de andocare.
enzima HAS este de așteptat să aibă cel puțin două situsuri de legare, unul pentru substraturile zahărului UDP și celălalt pentru zahărul polimeric pentru a cataliza formarea unei legături glicozidice12. Pentru a identifica locurile de legare în structura enzimei, am efectuat studii de andocare a substraturilor UDP-zahăr: UDP-N-acetilglucozamină și acid UDP-glucuronic. Regiunea de legare pentru substraturile UDP este evaluată printr-o grilă cu centrul său în domeniul glicoziltransferazei, așa cum este definit în metode.
locurile de legare ale substraturilor UDP se suprapun
simulările de andocare sunt efectuate separat pentru UDP-N-acetilglucozamină și acidul UDP-glucuronic. Sunt selectate conformatoare cu energie redusă (mai bune de 5 kcal/mol). Figura 3a prezintă frecvența contactelor diferitelor site-uri cu conformatori favorabili din punct de vedere energetic pe diferite parcursuri de simulare. Sunt prezentate reziduuri polare cu o frecvență de cel puțin 10% la oricare dintre cele două substraturi. Observația notabilă din figură este că locurile de legare pentru cele două substraturi de zahăr se suprapun.

(a) frecvența reziduurilor de contactare a ligandului pentru conformatorii favorabili din punct de vedere energetic ai UDP-n Acetilglucozaminei (UDP-GlcNAc) și acidului Glucuronic UDP – D (UDP-GlcA). Frecvența este reprezentată grafic pe axa X și site-uri pe axa Y. (B) rolul SSE1–4, SSE8 și SSE9 în legarea substratului UDP-zahăr. (C) rolul SSE6 în legarea ligandului. (D) rolul SSEs în legarea polimerilor. (E) rolul SSE7. (i) buclă SSE7 în hialuronan sintază, (ii) buclă echivalentă în celuloză sintază, (iii) buclă echivalentă în glicoziltransferază neprocesivă. (F) energia minimizată are o structură care arată UDP-N-acetilglucozamină și dizaharidă a acidului glucuronic și a moeităților de N-acetilglucozamină.
rolul reziduurilor de contact a fost evaluat prin investigarea legării cu cel mai favorabil conformator biologic relevant din punct de vedere energetic. Selecția conformatorului este ghidată de apropierea inelului nucleotidic al UDP de SSE1 conservat evolutiv cunoscut a fi implicat în legarea nucleotidelor. Conformatoarele selectate din buzunarul de legare sunt prezentate în Fig. 3B. SSE1-SSE4, SSE6, SSE8 și SSE9 sunt implicate în legarea substratului (Fig. 3B). SSE1, SSE2 și SSE4 stabilizează în mare măsură partea uridină a substraturilor, în timp ce SSE3, SSE8 și SSE9 interacționează cu inelul de zahăr. Legarea inițială a inelului UDP al substratului cu enzima ar putea fi facilitată de (i) lanțul lateral al ASP-103 conservat al SSE2 (albastru, Fig. 3B) prin legături de hidrogen cu grupări polare de nucleotide și (ii) prin inel aromatic de Tyr-74 (verde, Fig. 3B) de la SSE1 până la interacțiunile de la-LA-LA-LA-LA-LA-LA-LA cu inelul uridinic al UDP. Lanț lateral de Glu-76 (verde, Fig. 3B) din SSE1 formează legături de hidrogen cu grupuri polare de zahăr riboză de UDP. Reziduul Asp-161 din SSE4 stabilizează grupul OH al inelului riboză, în timp ce Asp-159 stabilizează ionul metalic. Gln-295 și ARG-298 (albastru) din SSE9 ar putea interacționa și stabiliza grupul pirofosfat al nucleotidei UDP. Atomul NE Al Trp-299 se află la distanța de legare a H față de substratul de zahăr și probabil ajută la orientarea substratului. Asp-260 este echivalent topologic cu baza catalitică din celuloză sintază25. SSE8 deține Asp-260. Secvențial proximal față de acest reziduu sunt Asp-259 și Arg-261, ambele interacționând cu grupurile polare ale inelului de zahăr (verde). Reziduul ARG-140, alături de Lys-139, este parțial conservat și înlocuit doar cu Lys în omologii SeHAS. Acest reziduu se află în imediata apropiere a capătului n-terminal al Helix holding SSE8 (verde). Acest scop conține reziduuri Asp încărcate negativ care ar putea fi neutralizate de Arg-140.
reziduuri din SSE6 (Fig. 3C) creați o schelă pentru a susține liganzii la locul de legare. Bucla este plasată strategic și formează baza buzunarului de legare. Bucla se află, de asemenea, aproape de baza catalitică (SSE8) și de zahărul polimeric legat (discutat mai târziu). Așa cum s-a discutat mai sus, experimentele care utilizează n-etilimaleimidă plasează CYS-226 conservat al acestui element lângă siteul de legare a zahărului UDP19. Acest lucru este probabil implicat în menținerea pKa a micromediului la locul activ. Deși nu este esențială pentru activitate, se arată că mutația acestui reziduu la Ala influențează activitatea în SeHAS19,28. Lanțul lateral al Ser-227 este probabil implicat în stabilizarea conformației buclei prin interacțiuni cu lanțul principal. Gly-228 și Pro-229 asigură flexibilitatea și rigiditatea necesare conformației lanțului principal (Fig. 3C).
Lys-139 este dispensabil în SeHAS și are un rol în legarea substratului
evaluările de andocare sugerează un rol al Lys-139 în legarea ligandului. Studiile anterioare au raportat un rol de reglementare pentru acest reziduu în formele de mamifere ale HAS. La șoarece, o mutație la Arg are ca rezultat pierderea completă a activității24. În absența oricăror studii mutaționale în SeHAS, pentru a-i elucida în continuare rolul, am efectuat studii de mutație a Lys-139. Detaliile privind configurarea experimentală și testul sunt descrise în metode. Rezultatele experimentale și harta vectorială pMBAD utilizate pentru studiu sunt prezentate în Fig. 4A, respectiv B. Am mutat Lys-139 la Arg (K139R) cu scopul de a conserva sarcina în acea poziție. Mutația nu a dus la pierderea completă a activității, dar a avut un impact. Doar 34% activitate (producție HA) a fost reținută în comparație cu controlul care reiterează un rol funcțional semnificativ al acestui reziduu (Fig. 4A). Pentru a testa în continuare interacțiunea bazată pe încărcare între acest reziduu și substrat, am mutat Lys-139 încărcat pozitiv la Asp încărcat negativ (K139D). Încărcarea negativă la fața locului duce la reținerea a 82% activitate (producție HA) în comparație cu controlul. Această analiză sugerează un rol pentru acest reziduu în stabilizarea grupurilor polare ale substratului. Selecția substituțiilor ilustrează în continuare faptul că atât grupurile încărcate pozitiv, cât și cele încărcate negativ sunt găzduite la fața locului. Studiile noastre arată că acest reziduu influențează direct activitatea sintazei în SeHAS. Mutațiile din acest loc afectează funcția sintazei la niveluri considerabile.

studii de mutație pe SeHAS. (A) Activitatea relativă a mutanților SeHAS efectuată în acest studiu. Experimentele au fost efectuate în triplicate, iar eroarea standard pentru titrul HA a fost cuprinsă între 0,01 și 0,05. (B) pMBAD vector construct. genele hasA și hasB de la Streptococcus equi subsp. zooepidemicus au fost clonate secvențial. Pentru studiile mutaționale, hasA wildtype a fost înlocuit cu mutanți corespunzători.
SSE5 se leagă de polimer și influențează producția HA
cavitatea de deasupra regiunii de legare a substratului UDP formată din helice amfipatice este evaluată pentru legarea unității polimerice. Studiul de legare a polimerilor este limitat la dizaharida terminală implicată în formarea legăturii glicozidice. Studiile de andocare au fost efectuate cu unitatea dizaharidică HA cuprinzând un N-acetilglucozamină legat de 1-4 și acid D-Glucuronic în domeniul glicoziltransferazei. Au fost selectați conformatori energetici favorabili. Figura 3D prezintă o unitate dizaharidică HA andocată lângă buzunarul de legare. SSE5, SSE8 și SSE9 sunt implicate în legare (Fig. 3D). Reziduul Asp-260 de la SSE8 se află la distanța de lipire H până la grupa OH terminală a polimerului și este indicat printr-o linie punctată în Fig. 3D. ARG-261 din SSE8 se află aproape de polimer și ar putea interacționa cu grupurile Oh polare ale zahărului. Reziduul Trp-299 din SSE9 formează interacțiuni CH-Centauri cu zahărul terminal.
din câte știm, acesta este primul raport care face ipoteza implicării funcționale a reziduurilor din SSE5. Reziduurile cheie din SSE5 implicate în legarea la polimer sunt Arg-205, Tyr-206, Phe-210 și ARG-214. Arg-205 se află în imediata apropiere a dizaharidei andocate și este implicat în interacțiuni cu grupurile polare încărcate negativ ale fragmentului de zahăr. Tyr-206 sau fenilalanină în omologii SeHAS este văzut pentru a stabiliza reziduul Arg-205 prin interacțiuni cation-implacabil. Arg-214 sau Lys în secvențe omoloage se află în imediata apropiere a polimerului și aproape de Phe-210 parțial conservat cu care formează interacțiuni cation-implacabil. Consecința mutației reziduurilor din SSE5 nu este cunoscută. Aici, sondăm consecința mutării Tyr-206 și ARG-214 asupra funcției prin mutageneză direcționată pe site. Rezultatele noastre experimentale arată că perturbarea interacțiunilor cation-XV prin mutarea tirozinei aromatice la alanină (Y206A) are ca rezultat pierderea a 99% a activității HAS (producția de HA) (Fig. 4A). Pierderea acestei interacțiuni ar fi putut influența indirect legarea polimerului prin ARG-205 adiacent. În mod similar, mutația reziduului de arginină bazică la 214 la alanină (R214A) duce la pierderea completă a funcției (Fig. 4A). Interesant este că introducerea sarcinii negative (R214E) duce la pierderea funcției de 93% (Fig. 4A). Aceste rezultate iterează necesitatea unei sarcini pozitive nete la acest site pentru a facilita legarea și translocarea polimerilor. Aceste mutații indică interdependența activităților de legare/translocare a polimerilor și glicoziltransferază.
mai mult, enzima complexată cu cei doi liganzi (UDP-zahăr și dizaharidă) a fost minimizată energetic folosind câmpuri de forță chihlimbar. Figura 3F prezintă enzima legată de UDP-N-acetilglucozamină și dizaharidă formată din acid glucuronic legat și N-acetilglucozamină cu acid glucuronic la capătul polimeric. Detaliile privind protocolul de minimizare sunt descrise în metode.
Gln-248 (SSE7) este critică cu un rol plauzibil în tranziția conformației
Gln-248 este un reziduu conservat în SSE7, o buclă lungă departe de locul de legare. Bucla echivalentă atât în omologii procesivi, cât și în cei neprocesivi este secvențial diferită și prezintă conformații distincte în formele enzimatice legate de substrat și nelegate (Fig. 3E (ii)) 29,30,31 și Fig. 3e (iii) 1-4 galactosiltransferază, Cod PDB: 2fyd și 2fy7)32. Bucla din SeHAS este probabil să faciliteze poziționarea SSE8 pentru cataliză. Reziduul Gln-248 se află departe de buzunarul de legare; rolul exact al acestui reziduu nu a putut fi prezis pe baza acestor studii in-silico. Studiile de mutație internă arată că acest reziduu este important. Înlocuirea reziduului cu Ala duce la pierderea aproape completă a producției de HA (Fig. 4A).Rolul acestui reziduu este cercetat în continuare prin studii dinamice cu granulație grosieră și este discutat într-o secțiune ulterioară.
SS prezintă mișcare coordonată
paradigma actuală este structura-codifică-dinamică-codifică-funcție33,34,35. S-a recunoscut din ce în ce mai mult că fluctuațiile aleatorii ale atomilor în starea lor nativă ascund mișcarea coordonată care predispune proteina pentru modificări funcționale relevante în structură. Aceste mișcări pot fi capturate prin moduri de joasă frecvență în modelarea rețelei elastice. Aceste moduri sunt cunoscute a fi insensibile la detaliile structurale și energetice. Prin urmare, am folosit anizotropic Network Modeling (ANM), o abordare bazată pe ENM pentru a capta imaginea globală a dinamicii codificate de structura 3-D a SeHAS. Am folosit ProDy36 pentru calcule ANM. Detalii suplimentare sunt elaborate în secțiunea Metode. Mișcarea coordonată este reprezentată ca valori ale coeficientului de corelație între nodurile rețelei ANM. Valorile medii ale coeficientului de corelație au fost calculate pe baza primelor 50 de moduri. Figura 5A prezintă harta de corelare pentru SeHAS. Valorile coeficientului de corelație pozitivă indică faptul că atomii se deplasează în aceeași direcție. Clusterul de reziduuri proximale spațiale cu coeficient de corelație ridicat este considerat a fi important din punct de vedere structural și funcțional. Perechile de reziduuri cu valori pozitive mari corespund elementelor sub-structurale. Mai mult, corelația dintre perechile de reziduuri se extinde la regiuni din diferite ESS. SSE1-4 formează un subdomeniu care interacționează strâns (dreptunghi negru). În mod similar, SSE5-9 formează un subdomeniu interactiv coordonat (dreptunghi gri). Cele două subdomenii sunt separate de o regiune slab corelată. Mișcările globale intrinseci ilustrează coordonarea funcțională necesară în ceea ce privește legarea substratului la un capăt, prin SSE1-4 și legarea polimerilor la celălalt capăt (SSE5-9).

evaluarea dinamicii globale în SeHAS. (A) valorile medii ale coeficientului de corelație pentru SeHAS pentru perechile de reziduuri. Valorile medii ale coeficientului de corelație pentru Gln-248 (B) și Thr-283 (C) cu alte reziduuri de SeHAS.
am explorat în continuare dinamica SeHAS în ceea ce privește reziduul Gln-248. Fig. 5B prezintă distribuția valorilor coeficientului de corelație în raport cu alte reziduuri din SeHAS. Gln-248 prezintă valori pozitive mari cu SSE8, 9 și SSE3 care conțin reziduuri catalitice și de legare a substratului. O mișcare coordonată cu aceste SS evaluate prin ANM ilustrează în continuare rolul său în dinamica conformației relevante din punct de vedere funcțional.
studiul ANM este extins pentru a evalua efectul mutației asupra valorilor coeficientului de corelație. Pentru fiecare mutant, se obține un model structural folosind RaptorX26. Mutanții prezintă o suprapunere structurală ridicată cu o RMSD medie de aproximativ 1 Inqt pentru toți atomii în ceea ce privește structura proteinei WT. Pentru fiecare structură mutantă, valorile coeficientului de corelație cu privire la reziduurile mutante sunt calculate și comparate cu WT. Parcelele sunt prezentate în Fig. S2. Mutațiile la locurile 214, 248 și 283 prezintă diferențe substanțiale în valori în regiunile SSE.
reducerea alungirii polimerului final în SeHAS, un mecanism plauzibil în trei etape
în membrii prototipici ai familiei GLICOZILTRANSFERAZEI GT-2, cum ar fi celuloza sintază,biosinteza polimerului are loc de la capătul nereducător al polimerului în creștere25, 31. În astfel de sisteme, substraturile UDP acționează ca un donator care transferă zahărul în zahărul polimeric care acționează ca acceptor24. O legătură între zaharuri este creată din precursorii UDP legați de zahăr prin intermediul unei reacții de substituție SN2 cu deplasare directă. În această reacție, o etapă de deprotonare de către o bază catalitică funcționalizează acceptorul24. Atacul nucleofil al acestui grup de zahăr acceptor asupra donatorului printr-o singură stare de tranziție asemănătoare ionului de oxocarbeniu are ca rezultat reacția de transfer glicozil cu eliberarea UDP din zahărul donator și inversarea netă a stereochimiei la carbonul anomeric. Acest mecanism este ilustrat în Fig. 6A. SeHAS diferă de acest prototip. Se știe că HA se alungește de la capătul reducător12. Acest lucru implică (i) UDP este eliberat din capătul polimerului și nu substraturile UDP în timpul catalizei și (ii) inversarea donatorului și acceptorilor cu HA-UDP acționând ca donator și UDP-zahăr substrat ca acceptor. Pe baza peisajului legării ligandului și a cunoștințelor obținute despre arhitectura sitului activ, discutăm participarea liganzilor ca donator și acceptor și propunem un mecanism catalitic pentru transferul glicozilului în SeHAS (Vezi Fig. 6B).
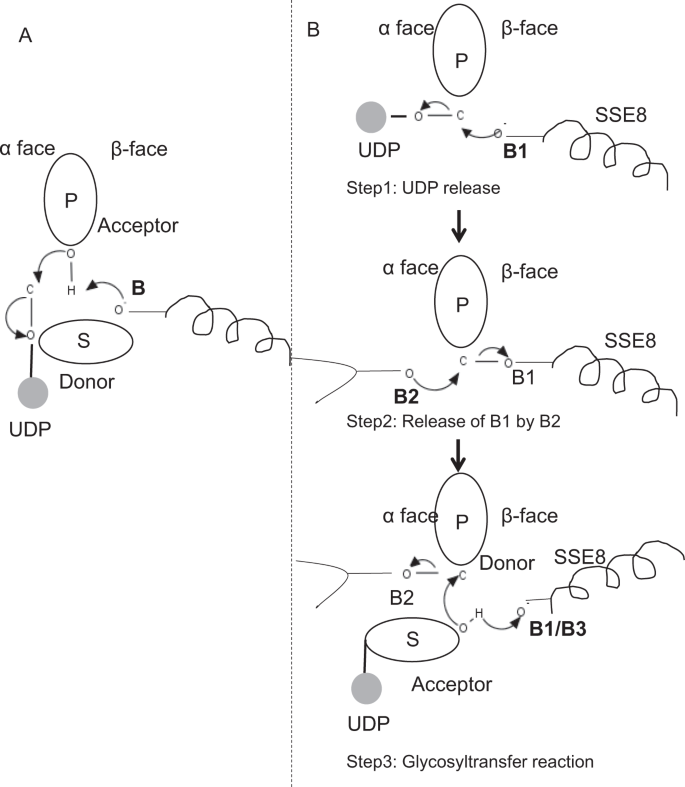
mecanismul molecular propus în SeHAS. (A) mecanism într-o glicoziltransferază prototipică cu chimie de inversiune. (B) mecanismul propus în clasa I are. P: zahăr polimeric, s: zahăr substrat.UDP este indicat ca un cerc. B1, B2 și B3 sunt bazele catalitice care participă la mecanismul de reacție.
reacția Glicoziltransferazei apare probabil în mai multe etape
ca prim pas, am explorat posibilitatea unei reacții de glicoziltransferază într-o singură etapă în mod asemănător celulozei sintazei. Dacă reacția glicoziltransferazei are loc într-o singură etapă, enzima la un moment dat ar trebui să dețină două părți UDP, una atașată la polimer și alta atașată la substratul de intrare. În scenariul alternativ în mai multe etape, UDP din polimer este eliberat înainte de apariția reacției catalitice. În acest caz, pentru a crea inversarea netă a stereochimiei, reacția ar avea loc într-o serie de număr impar de pași cu mecanismul SN2. Pentru a evalua ce scenariu este mai probabil, am efectuat studii de legare UDP prin andocarea moleculelor UDP în domeniul glicoziltransferazei. Evaluarea indică o suprapunere semnificativă a situsurilor de legare UDP și UDP-substrat.Rezultatul este prezentat în secțiunea suplimentară. O conformație exemplară favorabilă din punct de vedere energetic a UDP împreună cu regiunile de legare a substratului și a polimerilor sunt prezentate în Fig. S3. Deși evaluarea se bazează pe modelul static, plasarea a două molecule mari de natură chimică similară în imediata apropiere cu cerințele mediilor fizico-chimice similare este puțin probabilă pentru această enzimă. Speculăm că un pasaj căptușit cu reziduuri încărcate pozitiv din SSE9 și ionul metalic ar putea facilita eliberarea UDP de la capătul polimerului. Implicarea ionilor metalici în glicoziltransferază pentru eliberarea UDP este, de asemenea, bine documentată24. Deoarece cele două site-uri UDP nu se exclud reciproc, al doilea scenariu de reacție în mai multe etape pare mai probabil.
odată ce UDP este eliberat din polimer, un atac nucleofil din grupul OH de substrat–UDP (acceptor) ar crea o legătură glicozidică. Pentru a crea inversiune, eliberarea UDP și atacul nucleofil ulterior trebuie să apară de pe două fețe opuse ale zahărului polimeric. Propunem rolul a trei catalizatori de bază în schema generală de reacție care se află pe fețele de la centimetrii și centimetrii zahărului donator la capătul polimerului. Acești pași sunt ilustrați prin Fig. 6B și descrise mai jos.
a propus trei etape glicoziltransferază reacție
Pasul 1: UDP eliberare: Asp-260 din SSE8 ar putea acționa ca o bază (B1) și să inițieze eliberarea moleculei UDP din polimer (donator) de la fata-inqux. Această etapă ar crea o enzimă glicozilică legată covalent intermediar ecranat pe fața de la XV cu baza B1. Pentru a crea o inversiune, această față a zahărului trebuie să fie liberă pentru atacul nucleofil al grupului O-H de zahăr care intră. Prin urmare, o etapă intermediară, cu atacul nucleofil de la fața de la XV ar elibera fața de la XV gata pentru atacul nucleofil de zahăr acceptor.
Pasul 2: eliberarea B1 de către B2; explorarea rolului Thr-283: baza B2 pe fața de zahăr donator ar efectua un atac nucleofil asupra carbonului anomeric la Centrul de reacție și eliberarea B1. Studiile noastre structurale arată conservarea Gln-295 și Thr-283 pe această față. Eliberarea UDP poate duce la modificări conformaționale și poate aduce unul dintre aceste reziduuri în apropierea zahărului donator pentru cataliză. Mutația Gln-295 duce la o pierdere de activitate de până la 90%, dar rolul de bază nu este cunoscut20. Am evaluat posibilitatea ca un THR-283 conservat să locuiască într-o buclă pentru a funcționa ca a doua bază. Am mutat Thr la Ser conținând o grupă OH funcțională similară și la Ala cu lanț lateral alifatic mic. Ambii mutanți T283A și T283S prezintă o pierdere de ~95% a producției de HA (Fig. 4A). Acest reziduu prezintă o corelație pozitivă cu regiunile SSE4 și SSE6 și o regiune proximală spațial între reziduul 186 și reziduul 190 (Fig. 5C). Reziduul 188, deși nu este conservat, se află în vecinătatea substratului andocat (Fig. 3). Thr-283 nu prezintă o corelație pozitivă ridicată cu SSE8 care deține baza catalitică. Este posibil ca reziduul să acționeze ca un reziduu de bază suport în timpul reacției catalitice cu mișcarea sa coordonată cu regiunea de legare a substratului proximal spațial independentă de baza Asp-260 din SSE8. Ar fi necesare experimente suplimentare pentru a-și fundamenta rolul de bază. În general, studiul evidențiază încă un reziduu critic funcțional, necunoscut anterior.
Pasul 3: reacția de transfer glicozil: odată ce B1 este eliberat, se deblochează fața de carbon anomeric a zahărului polimeric pentru reacție. Deprotonarea substratului-UDP pe aceeași față de o a treia bază ar crea un grup nucleofil. Acest pas ar putea fi inițiat de B1 sau de o altă bază B3. Asp-259, lângă B1 este un reziduu foarte conservat în apropierea substratului-UDP și ar putea acționa ca B3. Cu toate acestea, B1/B3 este mai aproape de zahărul polimeric (donator), așa cum sa discutat în pasul 1. Pentru a iniția deprotonarea, B1 trebuie să fie în apropierea zahărului acceptor. S-ar putea realiza prin modificări de conformație la SSE8 asistate de SSE7. Spirala echivalentă din sintaza celulozei deține baza catalitică și suferă tranziții conformaționale coordonate pentru reacția glicoziltransferazei și translocarea. Un atac nucleofil al zahărului acceptor asupra carbonului anomeric al zahărului donator ar crea o legătură glicozidică și eliberarea bazei B2.