Quick Takes
- pomimo braku korzyści z wyników podłużnych w poprzednich badaniach klinicznych, ocena żywotności mięśnia sercowego może nadal odgrywać rolę na spersonalizowanym poziomie podejmowania decyzji klinicznych u pacjentów wysokiego ryzyka z umiarkowaną i zaawansowaną chorobą wieńcową.
- poprzednie badania wykorzystywały głównie tomografię komputerową z emisją pojedynczych fotonów (SPECT) i echokardiografię stresu dobutaminy do oceny żywotności; pojawiająca się technologia zapewnia wyższą czułość dzięki wzmocnionemu kontrastowi sercowo-naczyniowemu rezonansowi magnetycznemu (CMR) i wyższą swoistość z CMR stresu dobutaminy w celu przewidywania poprawy funkcji regionalnych po rewaskularyzacji.
- markery kliniczne, takie jak objawy niedokrwienne, jak również obecność naczyń docelowych do rewaskularyzacji, powinny być dokładnie zbadane przed oceną w celu nieinwazyjnej oceny żywotności.
wprowadzenie
choroby układu krążenia pozostają główną przyczyną śmiertelności i zachorowalności we współczesnej erze medycyny.1 przeprowadzono liczne badania naukowe koncentrujące się na strategiach zapobiegania chorobom układu sercowo-naczyniowego, aby zapobiec przyszłym ostrym zdarzeniom niedokrwiennym poprzez spowolnienie postępu miażdżycy i zmniejszenie ryzyka uszkodzenia płytki nazębnej i nałożonej zakrzepicy. Ocena żywotności mięśnia sercowego znajduje się na końcu tego spektrum i została zaprojektowana w celu wybrania pacjentów z kardiomiopatią niedokrwienną, u których może wystąpić odwrócenie dysfunkcji mięśnia sercowego.
ostre i nawracające zdarzenia niedokrwienne prowadzą do kardiomiopatii niedokrwiennej, która jest związana z nawracającymi hospitalizacjami, złą jakością życia i zwiększoną śmiertelnością. Proces ten można odwrócić, jeśli zidentyfikujemy dysfunkcyjne, ale żywotne komórki mięśnia sercowego u pacjentów z kardiomiopatią niedokrwienną. W ciągu ostatnich dziesięcioleci zdolność do wykrywania żywotnego mięśnia sercowego wzrosła wraz z nowymi technologiami w obrazowaniu układu sercowo-naczyniowego i nadal ewoluuje wraz ze wzrostem technologii.
pomimo wszystkich postępów w wykrywaniu żywotnych komórek mięśnia sercowego, nie udowodniono, aby obrazowanie żywotności miało wpływ na wynik kliniczny po rewaskularyzacji w badaniach prospektywnych.2,3 niniejszy artykuł dokona przeglądu aktualnej roli nieinwazyjnej oceny żywotności mięśnia sercowego w praktyce klinicznej i podsumuje kluczowe punkty niedawno opublikowanego dokumentu state of the art on imaging for myocardial livability document z American Heart Association (AHA).4
nieodwracalne i odwracalne uszkodzenie niedokrwienne: Zwłóknienie, hibernacja i oszałamianie
z przewlekłym zmniejszeniem przepływu krwi mięśnia sercowego, aktywacja kilku szlaków prowadzi do zapalenia, apoptozy,martwicy i ostatecznie tworzenia się blizn. Gdy ukrwienie jest znacznie zmniejszone, ale nie całkowicie zakłócone, uszkodzenie mięśnia sercowego może być w mniejszym stopniu; komórki mięśnia sercowego nadal będą żywotne i potencjalnie odzyskają swoją funkcję po przywróceniu ukrwienia. Istnieją dwa różne rodzaje dysfunkcji mięśnia sercowego w ustawieniu niedokrwienia: hibernacja i oszałamianie.
uporczywie zmniejszone ukrwienie może powodować obniżenie czynności mięśnia sercowego podczas hibernacji, podczas gdy ogłuszenie odnosi się do upośledzonej funkcji skurczowej pomimo normalnego przepływu spoczynkowego.5,6 niezależnie od przepływu krwi, rezerwa przepływu wieńcowego zmniejsza się w obu typach dysfunkcji mięśnia sercowego, co ostatecznie prowadzi do zmian strukturalnych i funkcjonalnych w mięśniu sercowym, powodując niedokrwienie popytu. Może również wystąpić zmniejszenie rezerwy przepływu wieńcowego u pacjentów bez choroby ograniczającej przepływ epikardialny, ale z ciężką dysfunkcją mikronaczyniową. Włókniaki lub tkanki zawału ma szkodliwy wpływ na przebudowę mięśnia sercowego i jest związany z niekorzystnymi skutkami; jednak nawet hibernacja mięśnia sercowego może służyć jako substrat do arytmii serca i zwiększać ryzyko nagłej śmierci sercowej.
nieinwazyjne metody obrazowania w celu oceny żywotności mięśnia sercowego
ocena wielkości i funkcji lewej komory za pomocą echokardiografii jest niezbędnym narzędziem do oceny żywotności mięśnia sercowego. Podczas gdy przerzedzenie ściany nie jest wiarygodne do oszacowania odwracalnej funkcji mięśnia sercowego, zwiększona wielkość lewej komory jest związana ze złym rokowaniem po rewaskularyzacji.
echokardiografia stresu dobutaminy jest szeroko stosowana do oceny kurczliwości i żywotności mięśnia sercowego. Przy ciągłym wlewie dobutaminy perfuzja mięśnia sercowego początkowo wzrasta wraz z kurczliwością, ale wraz ze wzrostem dawki dobutaminy przepływ krwi nie może być dalej zwiększany, co powoduje zmniejszoną kurczliwość. Zjawisko to jest znane jako reakcja dwufazowa, która przewiduje odzyskanie funkcji mięśnia sercowego po rewaskularyzacji.8
echokardiografia śledzenia plamek to kolejna pojawiająca się modalność, która może dokładnie oszacować odzyskiwanie lewej komory po zawale mięśnia sercowego. Obrazowanie perfuzji kontrastowej echo, które wykrywa integralność mikronaczyniową serca, jest również obiecujące; jednak ze względu na bardzo zmienną odtwarzalność, jego przydatność do oceny żywotności będzie wymagała dalszych badań.9
w ostatnich dziesięcioleciach, jednofotonowa emisyjna tomografia komputerowa (SPECT) i pozytonowa tomografia emisyjna (PET) były szeroko stosowane do oceny żywotności mięśnia sercowego. Będąc analogiem potasu, Tal może być stosowany do wykrywania integralności błony komórkowej mięśnia sercowego poprzez kanały ATPazy Na / K, gdzie żywotne komórki wykazują opóźniony wychwyt w porównaniu z obrazowaniem spoczynkowym.10 W przeciwieństwie do talu, SPECT oparty na technecie nie wykazuje opóźnionej dystrybucji.11 W ostatnich dziesięcioleciach Tal rzadko był używany ze względu na wzrost promieniowania jonizującego w porównaniu z technetem.
innym powszechnie stosowanym sposobem obrazowania jądrowego do oceny witalności mięśnia sercowego jest PET serca. W zdrowym mięśniu sercowym źródło energii pochodzi z kwasów tłuszczowych, podczas gdy w stanie niedokrwiennym przesuwa się w kierunku metabolizmu opartego na glukozie. 18F-fluorodeoksyglukoza (18F-FDG) może wykryć to przesunięcie w żywotnym mięśniu sercowym. Zwykle ocena żywotności składa się z obrazowania spoczynkowego i obrazowania metabolicznego za pomocą 18F-FDG. W obszarach bez perfuzji spoczynkowej, jak pokazano w przypadku amoniaku N-13 lub rubidu-82, obecność wychwytu 18F-FDG wskazuje na żywotność. W porównaniu do SPECT, PET ma wyższą rozdzielczość przestrzenną, niższe promieniowanie i lepszą korektę tłumienia. Warto zauważyć, że u pacjentów z insulinoopornością aktualizacja FDG w obszarze normalnym może pozostać mniejsza niż w regionach niedokrwiennych lub hibernacyjnych. Jednym z ograniczeń PET jest zmienność aktualizacji FDG, na którą może mieć wpływ pojemność minutowa serca, niewydolność serca, stopień niedokrwienia i aktywność współczulna.
gdy niedokrwienie utrzymuje się, dochodzi do apoptozy i martwicy mięśnia sercowego, co skutkuje zwiększeniem przestrzeni pozakomórkowej, którą można wykryć za pomocą opóźnionego wzmocnienia gadolinu (LGE) sercowo-naczyniowego rezonansu magnetycznego (CMR). U pacjentów z przewlekłą kardiomiopatią niedokrwienną, przezmuralny zakres LGE przewiduje odwracalność skurczu mięśnia sercowego po udanej rewaskularyzacji.Podczas gdy minimalny poziom LGE (<25%) w dysfunkcyjnym odcinku mięśnia sercowego wskazuje na duże prawdopodobieństwo powrotu do zdrowia, prawdopodobieństwo powrotu do zdrowia w przypadku >50% LGE zawału transmuralnego jest bardzo niskie.13 W związku z tym LGE CMR dostarcza użytecznych informacji, które pomogą w rewaskularyzacji. W segmentach z borderline zaangażowania LGE (25-50%), prognoza odzysku z LGE nie jest wystarczająco silna.13
spośród wszystkich powyższych badań, procent LGE grubości ścianki ma najwyższą czułość (95%), a dobutamina stres CMR ma najwyższą swoistość (91%), aby przewidzieć regionalną regenerację mięśnia sercowego, podczas gdy echokardiografia stresowa dobutaminy wykazała dobrą przewidywalność z 80% czułością i 78% swoistością. SPECT (87% i 83% dla obrazowania talu i technetu odpowiednio) i PET (92%) oparte na badaniach żywotności jądrowej mają dobrą czułość; jednak swoistość była niższa w porównaniu z innymi metodami (<70%).14-16
rola obrazowania żywotności w praktyce klinicznej
autorzy State of the Art: Imaging for Viability4 zaproponowali dwa różne algorytmy u pacjentów z przewlekłą (ryc. 1) i podostrą (ryc. 2) kardiomiopatią niedokrwienną. W przypadku obu algorytmów ważne jest, aby ocenić kilka czynników, które obejmują objawy, naczynia docelowe do rewaskularyzacji i stopień przebudowy.
1
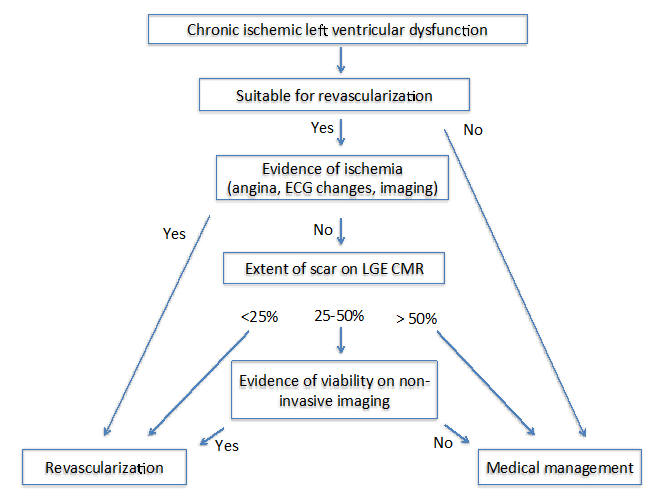
Rysunek 1

Rysunek 2
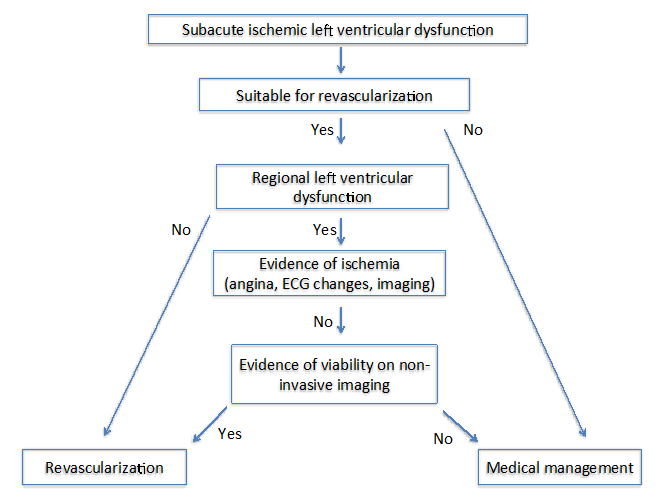
Rysunek 2

wpływ na ocenę żywotności na wynik
analiza podgrup badania klinicznego leczenia niedokrwiennej niewydolności serca (STICH) wykazała, że pacjenci z żywotnością mieli niższą śmiertelność długoterminową w porównaniu z pacjentami, którzy nie wykazywali żadnych oznak żywotności, oraz stwierdzono znaczącą poprawę frakcji wyrzutowej lewej komory (LVEF) u pacjentów, u których wykazano żywotność mięśnia sercowego, niezależnie od strategii leczenia. Jednak wyniki po pomostowaniu tętnic wieńcowych (ang. coronary artery bypass grafting, CABG) nie różniły się znacząco u pacjentów z żywotnością w porównaniu z pacjentami bez żywotności.3 poprawa LVEF była podobna u pacjentów z żywotnością, u których nastąpiła rewaskularyzacja, w porównaniu z pacjentami leczonymi leczeniem.3
warto zauważyć, że w badaniu STICH żywotność oceniano za pomocą echokardiografii stresowej dobutaminy lub SPECT. Jednakże, podobnie w badaniu F-18-fluorodeoksyglukoza z pozytronową tomografią emisyjną wspomaganym obrazowaniem pacjentów z ciężką dysfunkcją lewej komory i podejrzeniem choroby wieńcowej (PARR-2), wynik nie różnił się, gdy żywotność oceniano za pomocą PET u pacjentów z kardiomiopatią niedokrwienną poddawanych CABG.Nie jest jasne, dlaczego żywotność nie miała wpływu na wynik po rewaskularyzacji w porównaniu z terapią medyczną; może to być spowodowane pomyślnym wdrożeniem terapii medycznej lub może po prostu odzwierciedlać złożoność procesu podejmowania decyzji u tych pacjentów, w których wiele innych czynników ryzyka odgrywa rolę wykraczającą poza modalność obrazowania.
wniosek
chociaż nie wykazano, aby żywotność mięśnia sercowego miała wpływ na przeżywalność po rewaskularyzacji, nadal może odgrywać rolę w praktyce klinicznej, zwłaszcza u pacjentów wysokiego ryzyka z zaawansowanym wiekiem lub ze znaczącymi chorobami współistniejącymi, gdzie ryzyko i korzyści z rewaskularyzacji pozostają niejasne. U pacjentów z kardiomiopatią niedokrwienną i wysokim wskaźnikiem ryzyka Towarzystwa Chirurgów klatki piersiowej (STS) postępowanie jest złożone i przyszłe badania powinny nadal badać tę erę z obrazowaniem wielomodalnym z uwzględnieniem kilku innych czynników ryzyka, które mogą mieć wpływ na wynik.
podstawowe choroby współistniejące i charakterystyka pacjenta powinny być dokładnie zbadane, aby wybrać odpowiedni tryb obrazowania do oceny żywotności. Decyzję o zastosowaniu PET lub CMR podejmuje się indywidualnie. PET należy wziąć pod uwagę, gdy pacjent z dużym zawałem mięśnia sercowego, który uważano za nieopłacalny przez alternatywną technikę obrazowania, nadal ma oporną lub ograniczającą objawy dusznicę bolesną, zaostrzenia niewydolności serca pomimo maksymalnej terapii medycznej, komorowe zaburzenia rytmu serca lub znaczące zwężenie tętnicy wieńcowej, gdzie obecność nawet małej wyspy żywotnego mięśnia sercowego prawdopodobnie zmieni decyzję na korzyść rewaskularyzacji. U pacjentów z niewydolnością nerek lub wszczepionym urządzeniem sercowym preferowany jest PET. U pacjentów ze słabo kontrolowaną cukrzycą, znacznie zmniejszoną frakcją wyrzutową, o grubości końcowego rozkurczu mniejszej niż 6 mm lub u pacjentów ze zwężeniem w wielokrotnym rozkurczu tętnic wieńcowych należy unikać PET, podczas gdy u pacjentów z ciężką klaustrofobią, niewydolnością nerek lub obecnością wszczepionych urządzeń stosowanie CMR jest ograniczone i (lub) przeciwwskazane.
- Murray CJ, Lopez AD. Alternatywne prognozy dotyczące śmiertelności i niepełnosprawności ze względu na przyczynę. 1990-2020: global burden of disease study. Lancet 1997; 349: 1498-504.
- Bonow RO, Maurer G, Lee KL, et al. Żywotność mięśnia sercowego i przeżycie w niedokrwiennej dysfunkcji lewej komory. N Engl J Med 2011; 364: 1617-25.
- Panza JA, Ellis AM, Al-Khalidi HR, et al. Żywotność mięśnia sercowego i długoterminowe wyniki w kardiomiopatii niedokrwiennej. N Engl J Med 2019; 381: 739-8.
- Garcia MJ, Kwong ry, Scherrer-Crosbie m, et al. State of the art: imaging for myocardial viability: a scientific statement from the American Heart Association. Circ Cardiovasc Imaging 2020; Jul 13:.
- Bolli R. podstawowe i kliniczne aspekty oszałamiania mięśnia sercowego. Prog Cardiovasc Dis 1998; 40: 477-516.
- Ryan MJ, Perera D. identyfikacja i zarządzanie hibernacją mięśnia sercowego: co nowego, a co pozostaje nieznane? Curr Heart Fail Rep 2018;15:214-23.
- Canty JM Jr, Suzuki G, Banas MD, Verheyen F, Borgers M, Fallavollita JA. Hibernacja mięśnia sercowego: chronicznie przystosowana do niedokrwienia, ale podatna na nagłą śmierć. Circ Res 2004; 94: 1142-9.
- Hernandez-Pampaloni m, Peral V, Carreras JL, Sanchez-Harguindey L, Vilacosta I. dwufazowa odpowiedź na dobutaminę przewiduje poprawę dysfunkcji lewej komory po rewaskularyzacji: korelacja z emisją pozytonów i redystrybucją spoczynkową tomografii 201tl. Int J Cardiovasc Imaging 2003;19:519-28.
- Porter TR, Mulvagh SL, Abdelmoneim SS, et al. Kliniczne zastosowania ultradźwiękowych środków wzmacniających w echokardiografii: 2018 American Society of Echocardiography Guidelines update. J Am Soc Echocardiogr 2018;31: 241-74.
- Piwnica-Worms D, Chiu ML, Kronauge JF. Rozbieżna Kinetyka 201TL i 99mTc-SESTAMIBI w miocytach komorowych kurcząt hodowanych podczas zubożenia ATP. Obieg 1992;85: 1531-41.
- Berman DS, Kiat H, Van Train KF, Friedman J, Garcia EV, Maddahi J. porównanie SPECT z użyciem środków technetu-99m i talu-201 i PET do oceny perfuzji mięśnia sercowego i żywotności. Am J Cardiol 1990; 66:72E-79E.
- Löffler AI, Kramer CM. Badanie żywotności mięśnia sercowego w celu poprowadzenia rewaskularyzacji wieńcowej. Interv Cardiol Clin 2018; 7: 355-65.
- Kim RJ, Wu e, Rafael A, et al. Zastosowanie rezonansu magnetycznego wzmocnionego kontrastem do identyfikacji odwracalnej dysfunkcji mięśnia sercowego. N Engl J Med 2000; 343: 1445-53.
- Bax JJ, Poldermans D, Elhendy a, Boersma E, Rahimtoola SH. Czułość, swoistość i predykcyjne dokładności różnych nieinwazyjnych technik wykrywania hibernacji mięśnia sercowego. Curr Probl Cardiol 2001;26: 147-186.
- Bax JJ, van der Wall EE, Harbinson M. techniki radionuklidu do oceny żywotności mięśnia sercowego i hibernacji. Heart 2004; 90: v26-v33.
- Pagano D, Bonser R, Townend J, Ordoubadi F, Lorenzoni R, Camici P. Wartość prognostyczna echokardiografii dobutaminy i pozytonowej tomografii emisyjnej w identyfikacji hibernującego mięśnia sercowego u pacjentów z postischemiczną niewydolnością serca. Serce 1998;79: 281-8.
- Beanlands RSB, Nichol G, Huszti E, et al. F-18-fluorodeoksyglukoza pozytonowa tomografia emisyjna-wspomagane leczenie pacjentów z ciężką dysfunkcją lewej komory i podejrzeniem choroby wieńcowej: randomizowane, kontrolowane badanie (PARR-2). J Am Coll Cardiol 2007; 50: 2002-12.
tematy kliniczne: Zaburzenia rytmu serca i kliniczne EP, cukrzyca i choroba Kardiometaboliczna, Dyslipidemia, niewydolność serca i kardiomiopatie, obrazowanie nieinwazyjne, urządzenia do implantacji, zaburzenia rytmu SCD/komorowe, migotanie przedsionków/zaburzenia rytmu nadkomorowego, metabolizm lipidów, nowe środki, tomografia komputerowa, echokardiografia/USG, obrazowanie jądrowe
słowa kluczowe: Dyslipidemias, Apoptosis, Arrhythmias, Cardiac, Biological Phenomena, Atherosclerosis, Ammonia, Cardiomyopathies, Cicatrix, Cardiovascular Diseases, Constriction, Pathologic, Contrast Media, Coronary Vessels, Death, Sudden, Cardiac, Dobutamine, Down-Regulation, Echocardiography, Echocardiography, Stress, Extracellular Space, Fatty Acids, Fluorodeoxyglucose F18, Gadolinium, Glucose, Hemodynamics, Hibernation, Hospitalization, Inflammation, Insulin Resistance, Myocardial Ischemia, Ischemia, Multimodal Imaging, Myocardium, Myocytes, Cardiac, Plaque, Atherosclerotic, Positron-Emission Tomography, Rokowanie, potas, jakość życia, odtwarzalność wyników, czynniki ryzyka, rubid, radioizotopy rubidu, objętość udaru, TechNet, Tal, zakrzepica, tomografia, Obliczanie emisji, czynność Komorowa, Lewa
< powrót do listy