Quick Takes
- huolimatta pitkittäistuloshyödyn puutteesta aiemmissa kliinisissä tutkimuksissa, sydänlihaksen elinkelpoisuuden arvioinnilla voi silti olla merkitystä yksilöidyllä kliinisellä päätöksentekotasolla suuren riskin potilailla, joilla on keskivaikea ja pitkälle edennyt sepelvaltimotauti.
- aiemmissa tutkimuksissa käytettiin pääasiassa yksifotoniemissiotomografiaa (SPECT) ja dobutamiinistressin kaikukardiografiaa elinkykyisyyden arvioinnissa; kehittyvä teknologia tarjoaa suuremman herkkyyden varjolla tehostetulla sydän-ja verisuonimagneettisella resonanssilla (CMR) ja suuremman spesifisyyden dobutamiinistressillä CMR: llä ennustamaan alueellisen toiminnan paranemista revaskularisaation jälkeen.
- kliiniset merkkiaineet, kuten iskeemiset oireet sekä revaskularisaation kohdesuonien esiintyminen, on tutkittava huolellisesti ennen noninvasiivisen elinkelpoisuuden arviointia.
Johdanto
sydän-ja verisuonitaudit ovat edelleen johtava kuolleisuuden ja sairastuvuuden syy nykyaikana lääketieteessä.1 on ollut lukuisia tutkimuksia, joissa keskitytään sydän-ja verisuonitautien ehkäisyyn strategioita, jotka auttavat estämään tulevia akuutteja iskeemisiä tapahtumia hidastamalla ateroskleroosin etenemistä ja vähentämällä plakin häiriöiden ja päällekkäin tromboosin riskiä. Sydänlihaksen elinkelpoisuuden arviointi on ollut tämän spektrin päässä, ja se on suunniteltu valitsemaan potilaat, joilla on iskeeminen kardiomyopatia, joka voi osoittaa sydänlihaksen toimintahäiriön kääntymistä.
akuutit ja toistuvat iskeemiset tapahtumat johtavat iskeemiseen kardiomyopatiaan, johon liittyy toistuvia sairaalahoitoja, huono elämänlaatu ja lisääntynyt kuolleisuus. Tämä prosessi voidaan peruuttaa, jos voimme tunnistaa toimintahäiriöisiä mutta elinkelpoisia sydänlihassoluja potilailla, joilla on iskeeminen kardiomyopatia. Viime vuosikymmenten aikana kyky havaita elinkelpoinen sydänlihas on lisääntynyt kehittyvien teknologioiden myötä sydän-ja verisuonikuvauksissa ja kehittyy edelleen teknologian kasvaessa.
huolimatta kaikista edistysaskeleista elinkelpoisten sydänlihassolujen havaitsemisessa, elinkelpoisuuden kuvantamisella ei prospektiivisissa tutkimuksissa ole osoitettu olevan vaikutusta revaskularisaation jälkeiseen kliiniseen tulokseen.2,3 tässä artikkelissa tarkastellaan noninvasiivisen sydänlihaksen elinkelpoisuuden arvioinnin nykyistä roolia kliinisessä käytännössä ja tiivistetään keskeiset kohdat äskettäin julkaistussa American Heart Associationin (AHA) viimeisimmässä kuvantamista koskevassa dokumentissa sydänlihaksen elinkelpoisuudesta.4
peruuttamaton ja palautuva iskeeminen vaurio: Fibroosi, horrostila ja tainnutus
sydänlihaksen verenkierron kroonisessa vähenemisessä useiden reittien aktivoituminen johtaa tulehdukseen, apoptoosiin, nekroosiin ja lopulta arpikudoksen muodostumiseen. Kun verenkierto on huomattavasti vähentynyt, mutta ei täysin häiriintynyt, sydänlihasvaurio voi olla vähäisempi; sydänlihaksen solut olisivat edelleen elinkelpoisia ja mahdollisesti palauttavat toimintansa verenkierron palautumisen jälkeen. Iskemian ympäristössä on kaksi erilaista sydänlihaksen toimintahäiriötä: horros ja tainnutus.
jatkuvasti heikentynyt verenkierto voi aiheuttaa sydänlihaksen toiminnan säätelyä lepotilassa, kun taas tainnutuksella tarkoitetaan supistumiskyvyn heikkenemistä normaalista lepovirrasta huolimatta.5,6 verenvirtauksesta riippumatta sepelvaltimon virtausreservi pienenee molemmissa sydänlihaksen toimintahäiriöissä, mikä johtaa lopulta sydänlihaksen rakenteellisiin ja toiminnallisiin muutoksiin aiheuttaen kysyntäiskemian. Sepelvaltimon virtausreservi voi pienentyä myös potilailla, joilla ei ole epikardiaalista virtausta rajoittavaa sairautta mutta joilla on vaikea mikrovaskulaarinen toimintahäiriö. Fibroseilla tai infarktikudoksella on haitallisia vaikutuksia sydänlihaksen remodelaatioon ja siihen liittyy haitallisia tuloksia; kuitenkin jopa horrostava sydänlihas voi toimia sydämen rytmihäiriöiden alustana ja lisätä sydänperäisen äkkikuoleman riskiä.7
noninvasiiviset Kuvantamistavat sydänlihaksen elinkelpoisuuden arvioimiseksi
vasemman kammion koon ja toiminnan arviointi kaikukardiografialla on keskeinen väline sydänlihaksen elinkelpoisuuden arvioinnissa. Vaikka seinämän harvennus ei ole luotettava arvio palautuvan sydänlihaksen toiminnan, lisääntynyt vasemman kammion koko liittyy huonoon ennusteeseen revaskularisaation jälkeen.
Dobutamiinistressin kaikukardiografiaa on käytetty laajalti sydänlihaksen supistuvuuden ja elinkelpoisuuden arviointiin. Jatkuvalla dobutamiini-infuusiolla sydänlihaksen perfuusio kasvaa aluksi supistumiskyvyn mukana, mutta dobutamiiniannoksen kasvaessa verenkiertoa ei voida lisätä entisestään, mikä johtaa supistumiskyvyn heikkenemiseen. Tämä ilmiö tunnetaan kaksifaasisena reaktiona, joka ennustaa sydänlihaksen toiminnan elpymistä revaskularisaation jälkeen.8
Speckle tracking ekokardiografia on toinen kehittymässä oleva modaliteetti, jolla voidaan tarkasti arvioida vasemman kammion palautumista sydäninfarktin jälkeen. Sydämen mikrovaskulaarisen eheyden toteava kaikukontrasti-perfuusiokuvaus on myös lupaava; erittäin vaihtelevan toistettavuuden vuoksi sen hyödyllisyys elinkelpoisuuden arvioinnissa vaatii kuitenkin lisätutkimuksia.9
viime vuosikymmeninä yksifotoniemissiotomografiaa (SPECT) ja positroniemissiotomografiaa (PET) on käytetty laajalti sydänlihaksen elinkelpoisuuden arvioinnissa. Koska talliumia on kalium analogi, sitä voidaan käyttää sydänlihaksen solukalvon eheyden havaitsemiseen Na/K ATPaasi-kanavien kautta, missä elinkelpoiset solut osoittavat viivästynyttä kertymistä verrattuna lepokuvaukseen.10 toisin kuin tallium, teknetium-pohjainen SPECT ei osoita viivästynyttä jakautumista.11 viime vuosikymmeninä talliumia on harvoin käytetty ionisoivan säteilyn lisääntymisen vuoksi verrattuna teknetiumiin.
toinen yleisesti käytetty ydinkuvantamistapa sydänlihaksen elinvoimaisuuden arvioimiseksi on sydämen PET. Terveessä sydänlihaksessa energianlähde on peräisin rasvahapoista, kun taas iskeemisessä tilassa se siirtyy kohti glukoosipohjaista aineenvaihduntaa. 18F-fluorodeoksiglukoosi (18F-FDG) voi havaita tämän muutoksen elinkelpoisessa sydänlihaksessa. Tavallinen elinkelpoisuuden arviointi koostuu lepokuvauksesta ja metabolisesta kuvantamisesta 18F-FDG: llä. Alueilla, joilla ei ole n-13-ammoniakin tai rubidium-82: n leväsperfuusiota, 18F-FDG: n kertymä osoittaa elinkelpoisuuden. SPECTIIN verrattuna PET: llä on suurempi avaruudellinen erottelukyky, pienempi säteily ja parempi vaimennuskorjaus. On huomattava, että potilailla, joilla on insuliiniresistenssi, FDG-päivitys normaalilla alueella voi jäädä vähäisemmäksi kuin iskeemisillä tai horrostavilla alueilla. PET: n yksi rajoitus on FDG-päivityksen vaihtelu, johon voi vaikuttaa sydämen ulostulo, sydämen vajaatoiminta, iskemian aste ja sympaattinen aktiivisuus.12
iskemian pitkittyessä esiintyy sydänlihaksen apoptoosia ja nekroosia, mikä johtaa solunulkoisen tilan lisääntymiseen, joka voidaan havaita gadoliniumin myöhäisellä tehostumisella (LGE) kardiovaskulaarisella magneettikuvauksella (CMR). Kroonista iskeemistä kardiomyopatiaa sairastavilla potilailla LGE: n transmuraalinen laajuus ennustaa sydänlihaksen supistumisen palautuvuutta onnistuneen revaskularisaation jälkeen.13 vaikka hyvin vähäinen myokardiaalisen segmentin LGE (<25%) viittaa suureen paranemisen todennäköisyyteen, transmuraalisen infarktin toipumisen todennäköisyys >50% LGE: lla on hyvin pieni.13 tältä osin LGE CMR tarjoaa hyödyllistä tietoa revaskularisaation ohjaamiseksi. Segmenteillä, joissa LGE on lähes osallisena (25-50%), LGE: n palautumisennuste ei ole riittävän vahva.13
kaikista edellä mainituista tutkimuksista LGE-prosenttiosuus seinämän paksuudesta on korkein herkkyys (95%), ja dobutamiinin stressin CMR-spesifisyys on korkein (91%) sydänlihaksen alueellisen palautumisen ennustamiseen, kun taas dobutamiinin stressin kaikukardiografia osoitti hyvän ennustettavuuden 80% herkkyydellä ja 78% spesifisyydellä. SPECT – (87% talliumin ja 83% teknetiumkuvantamisen osalta) ja PET – (92%) – pohjaisten ydinkelpoisuustutkimusten herkkyys on hyvä; spesifisyys on kuitenkin ollut alhaisempi verrattuna muihin modaliteetteihin (<70%).14-16
Elinkykykuvantamisen rooli kliinisessä käytännössä
tekijät: State of the art: Imaging for Viability4 ehdottivat kahta erilaista algoritmiä potilailla, joilla oli krooninen (Kuva 1) ja subakuutti (kuva 2) iskeeminen kardiomyopatia. Molempien algoritmien osalta on tärkeää arvioida useita tekijöitä, joihin kuuluvat oireet, revaskularisaation kohdealukset ja remodeling-aste.
Kuva 1
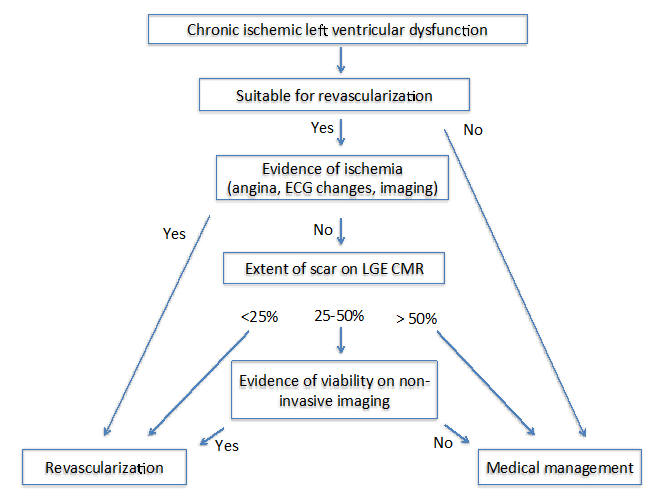
Kuva 1

kuva 2
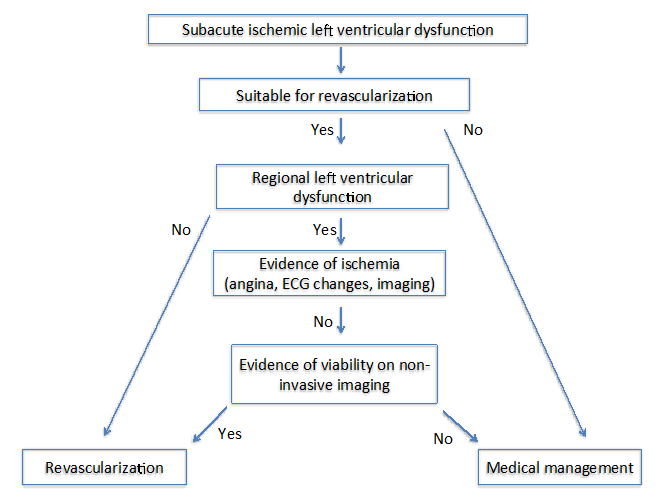
kuva 2

vaikutus elinkelpoisuuden arviointiin tulokseen
iskeemisen sydämen vajaatoiminnan leikkaushoitoa (STICH) koskevan tutkimuksen alaryhmäanalyysi osoitti, että elinkykyisillä potilailla oli pienempi pitkäaikaiskuolleisuus kuin potilailla, joilla ei ollut merkkejä elinkelpoisuudesta, ja vasemman kammion ejektiofraktio (LVEF) parani merkittävästi potilailla, joilla oli osoitettu sydänlihaksen elinkelpoisuus, hoitostrategiasta riippumatta. Sepelvaltimon ohitusleikkauksen (CABG) jälkeen saatu tulos ei kuitenkaan eronnut merkitsevästi potilailla, joilla oli elinkelpoisuus verrattuna potilaisiin, joilla ei ollut elinkelpoisuutta.3 LVEF: n paraneminen oli samanlaista revaskularisaatiopotilailla kuin potilailla, joita hoidettiin lääketieteellisellä hoidolla.3
Huom. STICH-tutkimuksessa elinkelpoisuus arvioitiin dobutamiinistressin kaikukardiografialla tai SPECTILLÄ. Vastaavasti F-18-fluorodeoksiglukoosi positroniemissiotomografiatutkimuksessa (PARR-2), jossa hoidettiin vaikeaa vasemman kammion toimintahäiriötä ja epäiltyä sepelvaltimotautia sairastavia potilaita, tulos ei kuitenkaan ollut erilainen, kun elinkelpoisuus arvioitiin PET: n avulla potilailla, joilla oli iskeeminen kardiomyopatia ja ohitusleikkaus.17 on epäselvää, miksi elinkelpoisuudella ei ollut vaikutusta revaskularisaation jälkeiseen tulokseen verrattuna lääketieteelliseen hoitoon; se voi johtua onnistuneen täytäntöönpanon lääketieteellisen hoidon, tai se voi yksinkertaisesti heijastaa monimutkaisuutta päätöksenteon kyseisillä potilailla, joissa useita muita riskitekijöitä on rooli kuin kuvantamistapa.
johtopäätös
vaikka sydänlihaksen elinkelpoisuudella ei ole osoitettu olevan vaikutusta eloonjäämiseen revaskularisaation jälkeen, sillä voi silti olla merkitystä kliinisessä käytännössä, erityisesti korkean riskin potilailla, joilla on korkea ikä tai merkittäviä liitännäissairauksia, joissa revaskularisaation riskit ja hyödyt ovat edelleen epäselviä. Potilailla, joilla on iskeeminen kardiomyopatia ja korkea Society of Thoracic Surgeons (STS) riskipisteet, hallinta on monimutkainen ja tulevissa tutkimuksissa olisi edelleen tutkia tätä aikakautta multimodaalisuuden kuvantaminen huomioon useita muita riskitekijöitä, jotka voivat vaikuttaa lopputulokseen.
taustalla olevat liitännäissairaudet ja potilaan ominaisuudet tulee käydä huolellisesti läpi oikean kuvantamistavan valitsemiseksi elinkelpoisuuden arviointia varten. Päätös PET: n tai CMR: n käytöstä tehdään potilaskohtaisesti. PET on harkittava, kun potilas, jolla on suuri sydäninfarkti, jonka luultiin olevan elinkelvoton vaihtoehtoisella kuvantamistekniikalla, on edelleen tulenkestävä tai oire, joka rajoittaa angina pectorista, sydämen vajaatoiminnan pahenemisvaiheita maksimaalisesta lääketieteellisestä hoidosta huolimatta, kammioarytmioita tai on merkittävä sepelvaltimon ahtauma, jossa jopa pienen elinkelpoisen sydänlihaksen saaren läsnäolo todennäköisesti muuttaa revaskularisaation hyväksi tehtävää päätöstä. Potilailla, joilla on munuaisten vajaatoiminta tai implantoitu sydänlaite, suositaan PET: tä. Potilailla, joilla on huonossa hoitotasapainossa oleva diabetes, vaikea ejektiofraktio, jonka loppudiastolinen paksuus on alle 6 mm, tai potilailla, joilla on ahtauma useiden sepelvaltimoiden jakaumassa, PET: n käyttöä tulee välttää, kun taas vaikeassa klaustrofobiassa, munuaisten vajaatoiminnassa tai implantoitujen laitteiden läsnä ollessa CMR: n käyttö on rajoitettua ja/tai vasta-aiheista.
- Murray CJ, Lopez AD. Vaihtoehtoiset ennusteet kuolleisuudesta ja vammaisuudesta syyn mukaan. 1990-2020: global burden of disease study. Lancet 1997; 349: 1498-504.
- Bonow RO, Maurer G, Lee KL, et al. Sydänlihaksen elinkelpoisuus ja eloonjääminen iskeemisessä vasemman kammion toimintahäiriössä. N Engl J Med 2011;364: 1617-25.
- Panza JA, Ellis AM, Al-Khalidi HR, et al. Sydänlihaksen elinkelpoisuus ja pitkän aikavälin tulokset iskeemisessä kardiomyopatiassa. N Engl J Med 2019;381: 739-8.
- Garcia MJ, Kwong RY, Scherrer-Crosbie M, et al. State of the art: imaging for myocardial livelability: a scientific statement from the American Heart Association. Circ Cardiovasc Imaging 2020; Heinä 13:.
- Bolli R. sydänlihaksen tainnutuksen perus-ja kliiniset näkökohdat. Prog Cardiovasc Dis 1998; 40: 477-516.
- Ryan MJ, Perera D. horrostilan tunnistaminen ja hallinta: mikä on uutta ja mikä jää tuntemattomaksi? Curr Heart Fail Rep 2018;15:214-23.
- Canty JM Jr, Suzuki G, Banas MD, Verheyen F, Borgers M, Fallavollita ja. Horrostava sydänlihas: kroonisesti sopeutunut iskemiaan, mutta altis äkkikuolemalle. Circ Res 2004;94:1142-9.
- Hernandez-Pampaloni M, Peral V, Carreras JL, Sanchez-Harguindey L, Vilacosta I. kaksifaasinen vaste dobutamiinille ennustaa vasemman kammion toimintahäiriön paranemista revaskularisaation jälkeen: korrelaatio positroniemissioiden ja rest-redigsion 201tl-tomografioiden kanssa. Int J Cardiovasc Imaging 2003; 19: 519-28.
- Porter TR, Mulvagh SL, Abdelmoneim SS, et al. Kliiniset Sovellukset ultraääni parantaa aineiden ekokardiografia: 2018 American Society of ekokardiografia suuntaviivat päivitys. J Am Soc Ekokardiogr 2018; 31: 241-74.
- Piwnica-Worms D, Chiu ML, Kronauge JF. 201tl: n ja 99mTc-SESTAMIBIN erilainen kinetiikka viljellyissä kanan kammioperäisissä myosyyteissä ATP-vajauksen aikana. Levikki 1992; 85: 1531-41.
- Berman DS, Kiat H, Van Train KF, Friedman J, Garcia EV, Maddahi J. SPECT: n vertailu käyttäen teknetium-99m-aineita ja tallium-201: tä ja PET: tä sydänlihaksen perfuusion ja elinkelpoisuuden arvioinnissa. Am J Cardiol 1990; 66: 72E-79E.
- Löffler AI, Kramer CM. Sydänlihaksen elinkelpoisuuden testaus sepelvaltimon revaskularisaation ohjaamiseksi. Interv Cardiol Clin 2018; 7: 355-65.
- Kim RJ, Wu E, Rafael A, et al. Varjoainetehosteisen magneettikuvauksen käyttö palautuvan sydänlihaksen toimintahäiriön tunnistamiseksi. N Engl J Med 2000; 343: 1445-53.
- Bax JJ, Poldermans D, Elhendy A, Boersma E, Rahimtoola SH. Eri noninvasive-tekniikoiden herkkyys, spesifisyys ja ennustavat tarkkuudet horrostavan sydänlihaksen havaitsemiseksi. Curr Probl Cardiol 2001;26:147-186.
- Bax JJ, van der Wall EE, Harbinson M. radionukliditekniikat sydänlihaksen elinkelpoisuuden ja lepotilan arvioimiseksi. Heart 2004; 90: v26-v33.
- Pagano D, Bonser R, Townend J, Ordoubadi F, Lorenzoni R, Camici P. Dobutamiinin kaikukardiografian ja positroniemissiotomografian ennustava arvo horrostavan sydänlihaksen tunnistamisessa potilailla, joilla on postiskeeminen sydämen vajaatoiminta. Heart 1998; 79: 281-8.
- Beanlands RSB, Nichol G, Huszti E, et al. F-18-fluorodeoxyglukoosi positroniemissiotomografia kuvantamisen avustama hoito potilailla, joilla on vaikea vasemman kammion toimintahäiriö ja epäilty sepelvaltimotauti: satunnaistettu, kontrolloitu tutkimus (PARR-2). J Am Coll Cardiol 2007; 50: 2002-12.
kliiniset aiheet: Rytmihäiriöt ja kliininen EP, Diabetes ja Kardiometabolinen sairaus, Dyslipidemia, sydämen vajaatoiminta ja kardiomyopatiat, Noninvasive-kuvantaminen, implantoitavat laitteet, SCD/kammioarytmiat, eteisvärinä/supraventrikulaariset rytmihäiriöt, rasva-aineenvaihdunta, uudet aineet, tietokonetomografia, kaikukardiografia/ultraääni, Ydinkuvaus
Asiasanat: Dyslipidemias, Apoptosis, Arrhythmias, Cardiac, Biological Phenomena, Atherosclerosis, Ammonia, Cardiomyopathies, Cicatrix, Cardiovascular Diseases, Constriction, Pathologic, Contrast Media, Coronary Vessels, Death, Sudden, Cardiac, Dobutamine, Down-Regulation, Echocardiography, Echocardiography, Stress, Extracellular Space, Fatty Acids, Fluorodeoxyglucose F18, Gadolinium, Glucose, Hemodynamics, Hibernation, Hospitalization, Inflammation, Insulin Resistance, Myocardial Ischemia, Ischemia, Multimodal Imaging, Myocardium, Myocytes, Cardiac, Plaque, Atherosclerotic, Positron-Emission Tomography, Ennuste, kalium, elämänlaatu, tulosten uusittavuus, riskitekijät, Rubidium, rubidium-radioisotoopit, aivohalvauksen tilavuus, teknetium, tallium, tromboosi, tomografia, Emissiolaskenta, kammion toiminta, vasen
< Takaisin listoihin