Quick Takes
- Nonostante la mancanza di benefici longitudinali nei precedenti studi clinici, la valutazione della vitalità miocardica può ancora svolgere un ruolo su un livello personalizzato di processo decisionale clinico per i pazienti ad alto rischio con malattia coronarica moderata e avanzata.
- Studi precedenti utilizzavano principalmente la tomografia computerizzata a emissione di fotoni singoli (SPECT) e l’ecocardiografia da stress da dobutamina per la valutazione della vitalità; la tecnologia emergente fornisce una maggiore sensibilità con contrasto maggiore risonanza magnetica cardiovascolare (CMR) e una maggiore specificità con dobutamina stress CMR per prevedere il miglioramento della funzione regionale dopo rivascolarizzazione.
- I marcatori clinici come i sintomi ischemici e la presenza di vasi bersaglio per la rivascolarizzazione devono essere attentamente esaminati prima della valutazione per la valutazione della vitalità non invasiva.
Introduzione
La malattia cardiovascolare rimane la principale causa di mortalità e morbilità nell’era moderna della medicina.1 Ci sono stati numerosi studi di ricerca incentrati sulle strategie di prevenzione cardiovascolare per aiutare a prevenire futuri eventi ischemici acuti rallentando la progressione dell’aterosclerosi e riducendo il rischio di rottura della placca e trombosi sovrapposta. Valutazione della vitalità miocardica è stato sulla fine di questo spettro ed è stato progettato per selezionare i pazienti con cardiomiopatia ischemica che possono presentare inversione della disfunzione miocardica.
Gli eventi ischemici acuti e ricorrenti portano a cardiomiopatia ischemica associata a ricoveri ricorrenti, scarsa qualità della vita e aumento della mortalità. Questo processo può essere invertito se possiamo identificare cellule miocardiche disfunzionali ma vitali in pazienti con cardiomiopatia ischemica. Negli ultimi decenni la capacità di rilevare il miocardio vitale è aumentata con le tecnologie emergenti nell’imaging cardiovascolare e continua ad evolversi man mano che la tecnologia cresce.
Nonostante tutti i progressi nella rilevazione di cellule miocardiche vitali, l’imaging della vitalità non ha dimostrato di avere un impatto sull’esito clinico dopo la rivascolarizzazione negli studi prospettici.2,3 Questo articolo esaminerà il ruolo attuale della valutazione della vitalità miocardica non invasiva nella pratica clinica e riassumerà i punti chiave nel documento di stato dell’arte recentemente pubblicato su imaging for myocardial viability document dell’American Heart Association (AHA).4
Danno ischemico irreversibile e reversibile: Fibrosi, ibernazione e stordimento
Con riduzione cronica del flusso sanguigno miocardico, l’attivazione delle diverse vie porta all’infiammazione, all’apoptosi, alla necrosi e infine alla formazione di tessuto cicatriziale. Quando l’apporto di sangue è marcatamente diminuito ma non completamente interrotto, il danno miocardico può essere di grado minore; le cellule miocardiche sarebbero ancora vitali e potenzialmente riacquistare la loro funzione dopo il ripristino dell’apporto di sangue. Ci sono due diversi tipi di disfunzione miocardica nell’ambito dell’ischemia: ibernazione e stordimento.
L’afflusso di sangue persistentemente diminuito può indurre la down-regolazione della funzione miocardica in ibernazione, mentre lo stordimento si riferisce alla funzione contrattile compromessa nonostante il normale flusso di riposo.5,6 Indipendentemente dal flusso sanguigno, la riserva di flusso coronarico è diminuita in entrambi i tipi di disfunzione miocardica, che alla fine porta ad alterazioni strutturali e funzionali nel miocardio causando ischemia della domanda. Ci può anche essere una diminuzione della riserva di flusso coronarico in pazienti senza malattia limitante del flusso epicardico ma con grave disfunzione microvascolare. Le fibrosi o il tessuto infartuato hanno effetti dannosi sul rimodellamento del miocardio ed è associato a esiti avversi; tuttavia, anche il miocardio in letargo può servire come substrato per le aritmie cardiache e aumentare il rischio di morte cardiaca improvvisa.7
Modalità di imaging non invasive per valutare la vitalità miocardica
La valutazione della dimensione e della funzione ventricolare sinistra con l’ecocardiografia è uno strumento essenziale per la valutazione della vitalità miocardica. Mentre il diradamento della parete non è affidabile per stimare la funzione miocardica reversibile, l’aumento delle dimensioni del ventricolo sinistro è associato a prognosi infausta dopo la rivascolarizzazione.
L’ecocardiografia da stress da dobutamina è stata ampiamente utilizzata per valutare la contrattilità miocardica e la vitalità. Con l’infusione continua di dobutamina, la perfusione miocardica aumenta inizialmente insieme alla contrattilità, ma all’aumentare della dose di dobutamina, il flusso sanguigno non può essere ulteriormente intensificato, con conseguente riduzione della contrattilità. Questo fenomeno è noto come reazione bifasica che predice il recupero della funzione miocardica dopo rivascolarizzazione.8
Speckle tracking l’ecocardiografia è un’altra modalità emergente che può stimare con precisione il recupero del ventricolo sinistro dopo infarto miocardico. L’imaging di perfusione echo contrast che rileva l’integrità microvascolare cardiaca è anche promettente; tuttavia, a causa della riproducibilità altamente variabile, la sua utilità per la valutazione della vitalità richiederà ulteriori indagini.9
Negli ultimi decenni, la tomografia computerizzata a emissione di fotoni singoli (SPECT) e la tomografia a emissione di positroni (PET) sono state ampiamente utilizzate per valutare la vitalità miocardica. Essendo un analogo del potassio, il tallio può essere utilizzato per rilevare l’integrità della membrana cellulare miocardica attraverso i canali Na / K ATPasi, dove le cellule vitali dimostrano un assorbimento ritardato rispetto all’imaging a riposo.10 A differenza del tallio, SPECT a base di tecnezio non dimostra una distribuzione ritardata.11 Negli ultimi decenni, il tallio è stato usato raramente a causa dell’aumento delle radiazioni ionizzanti rispetto al tecnezio.
Un’altra modalità di imaging nucleare comunemente utilizzata per valutare la vitalità miocardica è la PET cardiaca. In un miocardio sano, la fonte di energia deriva dagli acidi grassi, mentre in uno stato ischemico si sposta verso il metabolismo a base di glucosio. 18F-fluorodeossiglucosio (18F-FDG) può rilevare questo spostamento nel miocardio vitale. La valutazione usuale per la vitalità consiste nell’imaging rest e nell’imaging metabolico con 18F-FDG. Nelle aree senza perfusione a riposo come mostrato con ammoniaca N-13 o rubidio-82, la presenza di assorbimento di 18F-FDG indica la vitalità. Rispetto a SPECT, l’ANIMALE DOMESTICO ha una risoluzione spaziale più elevata, una radiazione inferiore e una migliore correzione dell’attenuazione. Da notare, nei pazienti con insulino-resistenza, l’aggiornamento FDG nell’area normale può rimanere inferiore a quello delle regioni ischemiche o ibernanti. Una limitazione della PET è la variabilità dell’aggiornamento FDG, che può essere influenzata da gittata cardiaca, insufficienza cardiaca, grado di ischemia e attività simpatica.12
Quando l’ischemia persiste, si verifica apoptosi miocardica e necrosi, che si traduce in un aumento dello spazio extracellulare che può essere rilevato dalla risonanza magnetica cardiovascolare (CMR) di potenziamento tardivo del gadolinio (LGE). Nei pazienti con cardiomiopatia ischemica cronica, l’estensione transmurale di LGE predice la reversibilità della contrazione miocardica dopo una rivascolarizzazione di successo.13 Mentre LGE minimo (< 25%) in un segmento miocardico disfunzionale indica un’alta probabilità di recupero, la possibilità di recupero in un >50% LGE di infarto transmurale è molto bassa.13 A questo proposito, LGE CMR fornisce informazioni utili per guidare la rivascolarizzazione. Nei segmenti con coinvolgimento LGE borderline (25-50%), la previsione di recupero con LGE non è abbastanza forte.13
Tra tutti gli studi di cui sopra, la percentuale LGE dello spessore della parete ha la più alta sensibilità (95%) e la CMR da stress da dobutamina ha la più alta specificità (91%) per predire il recupero miocardico regionale, mentre l’ecocardiografia da stress da dobutamina ha dimostrato una buona prevedibilità con sensibilità 80% e specificità 78%. Gli studi di fattibilità nucleare basati su SPECT (87% e 83% per l’imaging di tallio e tecnezio rispettivamente) e PET (92%) hanno una buona sensibilità; tuttavia, la specificità è stata inferiore rispetto ad altre modalità (<70%).14-16
Il ruolo dell’imaging della vitalità nella pratica clinica
Gli autori dello stato dell’arte: Imaging per la viabilità 4 hanno proposto due diversi algoritmi in pazienti con cardiomiopatia ischemica cronica (Figura 1) e subacuta (Figura 2). Per entrambi gli algoritmi, è importante valutare diversi fattori che includono i sintomi, i vasi bersaglio per la rivascolarizzazione e il grado di rimodellamento.
Figura 1
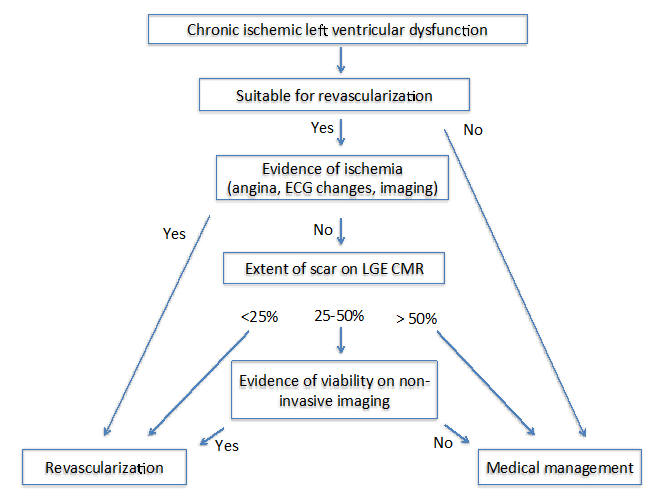
Figura 1

Figura 2
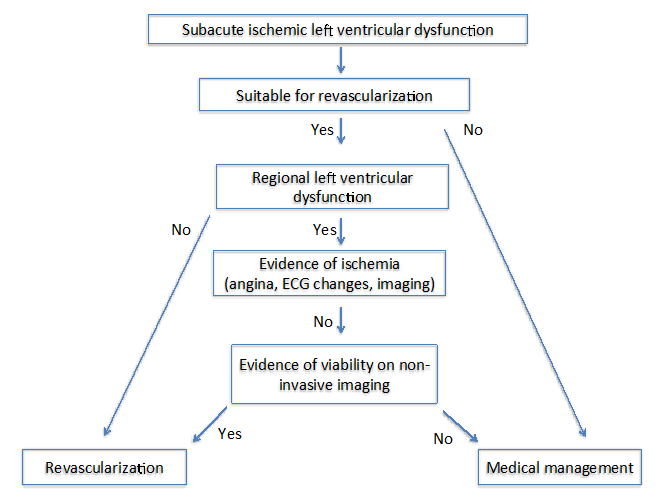
Figura 2

L’Impatto sulla Redditività di Valutazione sul Risultato
sottogruppo di analisi di Trattamento Chirurgico per Insufficienza Cardiaca Ischemica (STICH) prova ha mostrato che i pazienti con la vitalità erano più bassi di mortalità a lungo termine rispetto ai pazienti che non mostrano segni di vitalità, e c’era un miglioramento significativo nella frazione di eiezione ventricolare sinistra (LVEF) in pazienti che hanno dimostrato la vitalità del miocardio, indipendentemente dalla strategia di trattamento. Tuttavia, il risultato dopo l’innesto di bypass coronarico (CABG) non era significativamente diverso nei pazienti che avevano vitalità rispetto ai pazienti senza vitalità.3 Il miglioramento della LVEF è stato simile nei pazienti con vitalità che avevano rivascolarizzazione rispetto ai pazienti trattati con terapia medica.3
Da notare, nello studio STICH, la vitalità è stata valutata con ecocardiografia da stress da dobutamina o SPECT. Tuttavia, allo stesso modo nello studio F-18-fluorodeossiglucosio positron emission tomography imaging-assisted management di pazienti con grave disfunzione ventricolare sinistra e sospetta malattia coronarica (PARR-2), l’esito non è stato diverso quando la vitalità è stata valutata tramite PET in pazienti con cardiomiopatia ischemica sottoposti a CABG.17 Non è chiaro perché la vitalità non abbia avuto un impatto sull’esito dopo la rivascolarizzazione rispetto alla terapia medica; potrebbe essere dovuto al successo dell’implementazione della terapia medica, o potrebbe semplicemente riflettere la complessità del processo decisionale in quei pazienti, dove molti altri fattori di rischio giocano un ruolo al di là di una modalità di imaging.
Conclusione
Sebbene la vitalità miocardica non abbia dimostrato di avere un effetto sulla sopravvivenza dopo la rivascolarizzazione, potrebbe comunque svolgere un ruolo nella pratica clinica, specialmente nei pazienti ad alto rischio con età avanzata o con comorbidità significative in cui rischi e benefici della rivascolarizzazione rimangono poco chiari. Nei pazienti con cardiomiopatia ischemica e un punteggio di rischio High Society of Thoracic Surgeons (STS), la gestione è complessa e gli studi futuri dovrebbero continuare a esplorare questa era con l’imaging multimodale in considerazione di molti altri fattori di rischio che potrebbero influenzare il risultato.
Le comorbidità sottostanti e le caratteristiche del paziente devono essere attentamente esaminate per scegliere la modalità di imaging corretta per la valutazione della vitalità. La decisione di utilizzare PET o CMR viene presa su base paziente-paziente. ANIMALE domestico dovrebbe essere considerato quando un paziente con una grande infarto del miocardio, che è stato pensato per essere non vitali con un’altra tecnica di imaging continua refrattaria o sintomo di limitare l’angina, insufficienza cardiaca riacutizzazioni nonostante terapia medica massimale, aritmie ventricolari, o ha una stenosi coronarica significativa cui la presenza anche di una piccola isola di miocardio vitale probabilmente swing la decisione in favore di rivascolarizzazione. Nei pazienti con insufficienza renale o un dispositivo cardiaco impiantato, è preferibile la PET. Nei pazienti con diabete scarsamente controllato, frazione di eiezione gravemente ridotta, con spessore diastolico terminale inferiore a 6 mm, o in quelli con stenosi in distribuzione coronarica multipla, la PET deve essere evitata mentre in grave claustrofobia, insufficienza renale o presenza di dispositivi impiantati, l’uso della CMR è limitato e/o controindicato.
- Murray CJ, Lopez AD. Proiezioni alternative di mortalità e disabilità per causa. 1990-2020: global burden of disease study. Lancet 1997;349: 1498-504.
- Bonow RO, Maurer G, Lee KL, et al. Vitalità miocardica e sopravvivenza nella disfunzione ventricolare sinistra ischemica. N Engl J Med 2011;364: 1617-25.
- Panza JA, Ellis AM, Al-Khalidi HR, et al. Vitalità miocardica e risultati a lungo termine nella cardiomiopatia ischemica. N Engl J Med 2019;381: 739-8.
- Garcia MJ, Kwong RY, Scherrer-Crosbie M, et al. Stato dell’arte: imaging per la vitalità miocardica: una dichiarazione scientifica dell’American Heart Association. Circ Cardiovasc Imaging 2020; 13 lug:.
- Bolli R. Aspetti basilari e clinici dello stordimento miocardico. Prog Cardiovasc Dis 1998; 40: 477-516.
- Ryan MJ, Perera D. Identificazione e gestione del miocardio ibernato: cosa c’è di nuovo e cosa rimane sconosciuto? Curr Cuore Fail Rep 2018; 15: 214-23.
- Canty JM Jr, Suzuki G, Banas MD, Verheyen F, Borgers M, Fallavollita JA. Miocardio ibernante: cronicamente adattato all’ischemia ma vulnerabile alla morte improvvisa. Circ Res 2004;94: 1142-9.
- Hernandez-Pampaloni M, Peral V, Carreras JL, Sanchez-Harguindey L, Vilacosta I. La risposta bifasica alla dobutamina predice il miglioramento della disfunzione ventricolare sinistra dopo rivascolarizzazione: correlazione con tomografie di emissione di positroni e ridistribuzione di riposo 201Tl. Int J Cardiovasc Imaging 2003;19:519-28.
- Porter TR, Mulvagh SL, Abdelmoneim SS, et al. Applicazioni cliniche di agenti di miglioramento ultrasonico in ecocardiografia: 2018 American Society of Ecocardiography guidelines update. J Am Soc Ecocardiogr 2018;31: 241-74.
- Piwnica-Worms D, Chiu ML, Kronauge JF. Cinetica divergente di 201tl e 99mtc-SESTAMIBI in miociti ventricolari di pulcino in coltura durante la deplezione di ATP. Circolazione 1992;85: 1531-41.
- Berman DS, Kiat H, Van Train KF, Friedman J, Garcia EV, Maddahi J. Confronto di SPECT utilizzando agenti tecnezio-99m e tallio-201 e PET per la valutazione della perfusione miocardica e della vitalità. Am J Cardiol 1990; 66: 72E-79E.
- Löffler AI, Kramer CM. Test di vitalità miocardica per guidare la rivascolarizzazione coronarica. Interv Cardiol Clin 2018;7: 355-65.
- Kim RJ, Wu E, Rafael A, et al. L’uso della risonanza magnetica potenziata dal contrasto per identificare la disfunzione miocardica reversibile. N Engl J Med 2000; 343: 1445-53.
- Bax JJ, Poldermans D, Elhendy A, Boersma E, Rahimtoola SH. Sensibilità, specificità e precisioni predittive di varie tecniche non invasive per la rilevazione del miocardio ibernato. Curr Probl Cardiol 2001;26:147-186.
- Bax JJ, van der Wall EE, Harbinson M. Tecniche di radionuclidi per la valutazione della vitalità miocardica e del letargo. Cuore 2004; 90: v26-v33.
- Pagano D, Bonser R, Townend J, Ordoubadi F, Lorenzoni R, Camici P. Valore predittivo dell’ecocardiografia dobutamina e della tomografia ad emissione di positroni nell’identificazione del miocardio ibernato in pazienti con insufficienza cardiaca postischemica. Cuore 1998;79:281-8.
- Beanlands RSB, Nichol G, Huszti E, et al. F-18-fluorodeossiglucosio positrone emission tomography imaging-assisted management di pazienti con grave disfunzione ventricolare sinistra e sospetta malattia coronarica: uno studio randomizzato, controllato (PARR-2). J Am Coll Cardiol 2007;50: 2002-12.
Argomenti clinici: Aritmie e EP cliniche, Diabete e malattia cardiometabolica, Dislipidemia, Insufficienza cardiaca e cardiomiopatie, Imaging non invasivo, Dispositivi impiantabili, SCD/Aritmie ventricolari, Fibrillazione atriale/Aritmie sopraventricolari, Metabolismo lipidico, Nuovi agenti, Tomografia computerizzata, Ecocardiografia/Ultrasuoni, Imaging nucleare
Parole chiave: Dyslipidemias, Apoptosis, Arrhythmias, Cardiac, Biological Phenomena, Atherosclerosis, Ammonia, Cardiomyopathies, Cicatrix, Cardiovascular Diseases, Constriction, Pathologic, Contrast Media, Coronary Vessels, Death, Sudden, Cardiac, Dobutamine, Down-Regulation, Echocardiography, Echocardiography, Stress, Extracellular Space, Fatty Acids, Fluorodeoxyglucose F18, Gadolinium, Glucose, Hemodynamics, Hibernation, Hospitalization, Inflammation, Insulin Resistance, Myocardial Ischemia, Ischemia, Multimodal Imaging, Myocardium, Myocytes, Cardiac, Plaque, Atherosclerotic, Positron-Emission Tomography, Prognosi, Potassio, Qualità della vita, Riproducibilità dei risultati, Fattori di rischio, Rubidio, Radioisotopi di rubidio, Volume della corsa, tecnezio, tallio, Trombosi, Tomografia, Emissione calcolata, Funzione ventricolare, Sinistra
<Torna agli elenchi