generelt
vandets faste tilstand er kendt som IS; den gasformige tilstand er kendt som vanddamp (eller damp). Temperaturenhederne (tidligere graden Celsius og nu Kelvin) er defineret i form af det tredobbelte vandpunkt, 273,16 K (0,01 liter C) og 611,2 Pa, temperaturen og trykket, hvor fast, flydende og gasformigt vand sameksisterer i ligevægt. Vand udviser nogle meget mærkelige opførsler, herunder dannelse af tilstande som glasagtig is, en ikke-krystallinsk (glasagtig), fast tilstand af vand.
ved temperaturer større end 647 K og tryk større end 22.064 MPa antager en samling vandmolekyler en superkritisk tilstand, hvor væskelignende klynger flyder inden for en damplignende fase.
den flydende vandvej er et mål for mængden af flydende vand i en luftkolonne.
vandmolekylets dipolære natur
et vigtigt træk ved vandmolekylet er dets polære natur. Vandmolekylet danner en vinkel med hydrogenatomer ved spidserne og ilt ved toppunktet. Da ilt har en højere elektronegativitet end hydrogen, har molekylets side med iltatomet en delvis negativ ladning. Et molekyle med en sådan ladningsforskel kaldes en dipol. Ladningsforskellene får vandmolekyler til at blive tiltrukket af hinanden (de relativt positive områder tiltrækkes af de relativt negative områder) og til andre polære molekyler. Denne attraktion er kendt som hydrogenbinding.
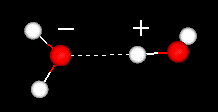 hydrogenbinding mellem to vandmolekyler
hydrogenbinding mellem to vandmolekyler
denne relativt svage (i forhold til de kovalente bindinger i selve vandmolekylet) tiltrækning resulterer i fysiske egenskaber, såsom et relativt højt kogepunkt, fordi en masse varmeenergi er nødvendig for at bryde hydrogenbindingerne mellem molekyler. For eksempel er svovl elementet under ilt i det periodiske system, og dets ækvivalente forbindelse, hydrogensulfid (H2S) har ikke hydrogenbindinger, og selvom det har dobbelt så meget molekylvægt af vand, er det en gas ved stuetemperatur. Den ekstra binding mellem vandmolekyler giver også flydende vand en stor specifik varmekapacitet.
hydrogenbinding giver også vandmolekyler en usædvanlig opførsel ved frysning. Ligesom de fleste andre materialer bliver væsken tættere med sænkning af temperaturen. I modsætning til de fleste andre materialer betyder tilstedeværelsen af hydrogenbindinger, når de afkøles til nær frysepunkt, at molekylerne, når de omarrangeres for at minimere deres energi, danner en struktur, der faktisk har lavere densitet: derfor vil den faste form, is, flyde i vand. Med andre ord udvides vandet, når det fryser (de fleste andre materialer krymper ved størkning). Flydende vand når sin højeste tæthed ved en temperatur på 4 kg C. Dette har en interessant konsekvens for vandlevelsen om vinteren. Vand, der køles ved overfladen, bliver tættere og synker og danner konvektionsstrømme, der afkøler hele vandkroppen, men når temperaturen på søvandet når 4 kg C, bliver vand på overfladen, når det kulderystes yderligere, mindre tæt og forbliver som et overfladelag, der til sidst danner is. Da nedadgående konvektion af koldere vand er blokeret af densitetsændringen, enhver stor vandmasse frosset om vinteren vil have størstedelen af sit vand stadig flydende ved 4 kg C under den iskolde overflade, så fisk kan overleve. Dette er et af de vigtigste eksempler på finjusterede fysiske egenskaber, der understøtter livet på jorden, der bruges som et argument for det antropiske princip.
en anden konsekvens er, at is smelter, hvis der påføres tilstrækkeligt tryk.
struktur af vand og is
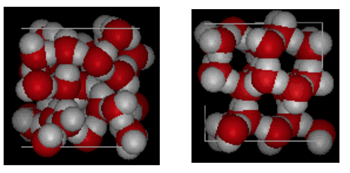
vist ovenfor er en side om side sammenligning af en kasse 10 Ångstrøm tværs. Det viser tydeligt, at Is tager mere plads på grund af den hydrogenbinding, der opstår, når tilstanden ændres fra væske til fast stof. I ice Ih danner hvert vand fire hydrogenbindinger med o – – – o afstande på 2,76 Ångstrøm til nærmeste iltnabo. På grund af ordnet struktur i is er der mindre H20 molekyler i et givet rum af volumen.
vand som opløsningsmiddel
vand er også et godt opløsningsmiddel på grund af dets polaritet. Vandets opløsningsmiddelegenskaber er afgørende i biologien, fordi mange biokemiske reaktioner kun finder sted inden for vandige opløsninger (f.eks. reaktioner i cytoplasma og blod). Derudover bruges vand til at transportere biologiske molekyler.
når en ionisk eller polær forbindelse kommer ind i vand, er den omgivet af vandmolekyler. Den relativt lille størrelse af vandmolekyler tillader typisk mange vandmolekyler at omslutte et molekyle opløst stof. De delvist negative dipoler af vandet tiltrækkes af positivt ladede komponenter i det opløste stof og omvendt for de positive dipoler.
generelt er ioniske og polære stoffer som syrer, alkoholer og salte let opløselige i vand, og ikke-polære stoffer som fedtstoffer og olier er det ikke. Ikke-polære molekyler forbliver sammen i vand, fordi det er energisk mere gunstigt for vandmolekylerne at hydrogenbinde til hinanden end at engagere sig i Van Der-interaktioner med ikke-polære molekyler.
et eksempel på et ionisk opløst stof er bordsalt; natriumchloridet, NaCl, adskilles i Na+ kationer og Cl – anioner, der hver er omgivet af vandmolekyler. Ionerne transporteres derefter let væk fra deres krystallinske gitter til opløsning. Et eksempel på et ikke-ionisk opløst stof er bordsukker. Vanddipolerne hydrogenbinding til de dipolære områder af sukkermolekylet og tillader det at blive ført væk i opløsning.
samhørighed og overfladespænding
de stærke hydrogenbindinger giver vand en høj sammenhængskraft og dermed overfladespænding. Dette er tydeligt, når små mængder vand sættes på en uopløselig overflade, og vandet forbliver sammen som dråber. Denne funktion er vigtig, når vand føres gennem stængler i planter; de stærke intermolekylære attraktioner holder vandkolonnen sammen og forhindrer spændinger forårsaget af transpirationstræk. Andre væsker med lavere overfladespænding ville have en højere tendens til at” rive”, danne vakuum-eller luftlommer og gøre karret ude af drift.
ledningsevne
rent vand er faktisk en god isolator (dårlig leder), hvilket betyder, at det ikke leder elektricitet godt. Fordi vand er et så godt opløsningsmiddel, har det dog ofte noget opløst stof opløst i det, oftest salt. Hvis vand har sådanne urenheder, kan det lede elektricitet meget bedre, fordi urenheder som salt omfatter frie ioner i vandig opløsning, hvorved en elektrisk strøm kan strømme.
elektrolyse
vand kan opdeles i dets bestanddele, hydrogen og ilt, ved at føre en strøm gennem den. Denne proces kaldes elektrolyse. Vandmolekyler adskilles naturligt i H+ og OH – ioner, som trækkes mod henholdsvis katoden og anoden. Ved katoden opfanger to H + – ioner elektroner og danner H2-gas. Ved anoden kombinerer fire OH – ioner og frigiver O2-gas, molekylært vand og fire elektroner. Gasserne producerede boble til overfladen, hvor de kan opsamles.
reaktivitet
kemisk er vand amfotere: i stand til at fungere som en syre eller base. Lejlighedsvis bruges udtrykket hydroksinsyre, når vand fungerer som en syre i en kemisk reaktion. Ved en pH på 7 (neutral) er koncentrationen af hydroksidioner (OH-) lig med koncentrationen af hydronium (H3O+) eller hydrogenioner (H+) ioner. Hvis ligevægten forstyrres, bliver opløsningen sur (højere koncentration af hydroniumioner) eller basisk (højere koncentration af hydroksidioner).
vand kan fungere som enten en syre eller en base i reaktioner. Ifølge br-systemet defineres en syre som en art, der donerer en proton (en H+ ion) i en reaktion, og en base som en, der modtager en proton. Når man reagerer med en stærkere syre, fungerer vand som en base; når man reagerer med en svagere syre, fungerer den som en syre. For eksempel modtager den en H+ ion fra HCl i ligevægten:
HCl + H2O —> H3O+ + Cl-
her fungerer vand som base ved at modtage en H+ ion. En syre donerer en H + ion, og vand kan også gøre dette, såsom i reaktionen med ammoniak, NH3:
NH3 + H2O —> NH4+ + OH-
pH i praksis
i teorien har rent vand en pH på 7. I praksis er rent vand meget vanskeligt at producere. Vand, der efterlades udsat for luft i længere tid, vil hurtigt opløse kulsyre og danne en opløsning af kulsyre med en begrænsende pH på ~5,7 (reference: Kendall, J. (1916), Tidsskrift for American Chemical Society 38 (11): 2460-2466).
rensende vand
renset vand er nødvendigt til mange industrielle applikationer såvel som til forbrug. Mennesker har brug for vand, der ikke indeholder for meget salt eller andre urenheder. Almindelige urenheder inkluderer kemikalier eller skadelige bakterier. Nogle opløste stoffer er acceptable og endda ønskelige for opfattet smagsforbedring. Vand, der er egnet til at drikke, kaldes drikkevand.
seks populære metoder til rensning af vand er:
- filtrering: Vand ledes gennem en sigte, der fanger små partikler. Jo strammere sigtens maske er, desto mindre skal partiklerne passere igennem. Filtrering er ikke tilstrækkelig til fuldstændigt at rense vand, men det er ofte et nødvendigt første skridt, da sådanne partikler kan forstyrre de mere grundige rensningsmetoder.
- kogning: vand opvarmes til dets kogepunkt længe nok til at inaktivere eller dræbe mikroorganismer, der normalt lever i vand ved stuetemperatur. I områder, hvor vandet er “hårdt” (indeholdende opløste calciumsalte), dekomponerer kogning bicarbonationen, hvilket resulterer i, at nogle (men ikke alle) af det opløste calcium udfældes i form af calciumcarbonat. Dette er den såkaldte “pels”, der bygger sig op på kedelelementer osv. i områder med hårdt vand. Med undtagelse af calcium fjerner kogning ikke opløste stoffer med højere kogepunkt end vand og øger faktisk deres koncentration (på grund af at noget vand går tabt som damp)
- Carbonfiltrering: Trækul, en form for kulstof med et højt overfladeareal på grund af dets fremstillingsmetode, adsorberer mange forbindelser, herunder nogle giftige forbindelser. Vand ledes gennem aktivt kul for at fjerne sådanne forurenende stoffer. Denne metode bruges mest i husholdningsvandfiltre og fisketanke. Husholdningsfiltre til drikkevand indeholder undertiden også sølv, spormængder af sølvioner, der har en bakteriedræbende virkning.
- destillation: destillation indebærer kogning af vandet for at producere vanddamp. Vanddampen stiger derefter til en afkølet overflade, hvor den kan kondensere tilbage til en væske og opsamles. Da de opløste stoffer normalt ikke fordampes, forbliver de i den kogende opløsning. Selv destillation renser ikke fuldstændigt vand på grund af forurenende stoffer med lignende kogepunkter og dråber af ikke-fordampet væske, der bæres med dampen. Imidlertid kan 99,9% rent vand opnås ved destillation.
- omvendt osmose: mekanisk tryk påføres en uren opløsning for at tvinge rent vand gennem en semipermeabel membran. Udtrykket er omvendt osmose, fordi normal osmose ville resultere i, at rent vand bevæger sig i den anden retning for at fortynde urenhederne. Omvendt osmose er teoretisk den mest grundige metode til storskala vandrensning til rådighed, selvom perfekte semi-permable membraner er vanskelige at skabe. ved udvekslingskromatografi: i dette tilfælde ledes vand gennem en ladet harpikssøjle, der har sidekæder, der fanger calcium, magnesium og andre tungmetalioner. I mange laboratorier har denne rensningsmetode erstattet destillation, da den giver et stort volumen meget rent vand hurtigere og med mindre energiforbrug end andre processer. Vand renset på denne måde kaldes deioniseret vand.
spild af vand
spild af vand er misbrug af vand, dvs.at bruge det unødigt. Et eksempel er brugen af vand, især vand renset til menneskelige sikre drikkestandarder, i unødvendig kunstvanding. Også i boliger kan vand spildes, hvis toilettet skylles unødigt, eller tanken lækker. At få vand til at blive forurenet kan være det største enkelt misbrug af vand. I det omfang et forurenende stof begrænser andre anvendelser af vandet, bliver det spild af ressourcen, uanset fordelene for forureneren.
mytologi
vand er et af de fire klassiske elementer sammen med ild, jord og luft og blev betragtet som ylem eller grundlæggende ting i universet. Vand blev betragtet som koldt og fugtigt. I teorien om de fire kropslige humours blev vand forbundet med slim. Vand var også et af de fem elementer i kinesisk Taoisme sammen med jord, ild, træ og metal.
vandrettigheder og udvikling
UNESCOs verdens Vandudviklingsrapport (2003) fra dets Verdensvandsvurderingsprogram viser, at verden i de næste 20 år står over for en hidtil uset mangel på drikkevand. Mængden af vand til rådighed for alle forventes at falde med 30%. Årsagerne er forurening, global opvarmning og politiske problemer. Mere end 2,2 millioner mennesker døde i 2000 af sygdomme relateret til forbruget af forurenet vand. I 2004 rapporterede den britiske velgørenhedsorganisation Vandaid, at et barn dør hvert 15.sekund på grund af let forebyggelige vandrelaterede sygdomme.Rapporten viser store globale forskelle i den rå mængde tilgængeligt vand: fra 10 m3 pr.person om året til 812.121 m3 i Fransk Guyana. Men rigere lande som Danmark kan lettere klare lav vandtilgængelighed. I USA er vandloven delt mellem to juridiske doktriner: riparian vand rettigheder, der anvendes i de østlige og sydlige stater, hvor der er en overflod af vand og bevillingsdoktrinen (eller Colorado-doktrinen), der anvendes i de tørre vestlige stater.