yleinen
veden kiinteä olomuoto tunnetaan jäänä; kaasumainen olomuoto tunnetaan vesihöyrynä (tai höyrynä). Lämpötilan yksiköt (aiemmin celsiusaste ja nykyään Kelvin) määritellään veden kolmoispisteen, 273,16 K: n (0,01 °C) ja 611,2 Pa: n, eli sen lämpötilan ja paineen mukaan, jossa kiinteä, nestemäinen ja kaasumainen vesi ovat tasapainossa keskenään. Vesi esiintyy joitakin hyvin outoja käyttäytymistä, mukaan lukien muodostumista valtioiden kuten lasiaisen jään, noncrystalline (lasimainen), kiinteä tila vettä.
yli 647 K: n lämpötilassa ja yli 22,064 MPa: n paineessa vesimolekyylikokoelma olettaa ylikriittisen tilan, jossa nestemäiset klusterit kelluvat höyryn kaltaisessa faasissa.
nestemäisen veden reitti on ilmapatsaassa olevan nestemäisen veden määrän mitta.
vesimolekyylin dipolaarinen luonne
vesimolekyylin tärkeä piirre on sen polaarinen luonne. Vesimolekyyli muodostaa kulman, jonka kärjissä on vetyatomeja ja kärkipisteessä happea. Koska hapen elektronegatiivisuus on suurempi kuin vedyn, molekyylin puolella happiatomin kanssa on osittainen negatiivinen varaus. Molekyyliä, jolla on tällainen varausero, kutsutaan dipoliksi. Varauserot aiheuttavat vesimolekyylien vetovoiman toisiinsa (suhteellisen positiiviset alueet vetävät puoleensa suhteellisen negatiivisia alueita) ja muihin polaarisiin molekyyleihin. Tätä vetovoimaa kutsutaan vetysidokseksi.
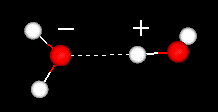 vetysidos kahden vesimolekyylin välillä
vetysidos kahden vesimolekyylin välillä
tämä suhteellisen heikko (suhteessa itse vesimolekyylin kovalenttisiin sidoksiin) vetovoima johtaa fysikaalisiin ominaisuuksiin, kuten suhteellisen korkeaan kiehumispisteeseen, koska molekyylien välisten vetysidosten katkaisemiseen tarvitaan paljon lämpöenergiaa. Esimerkiksi rikki on jaksollisessa järjestelmässä hapen alapuolella oleva alkuaine, eikä sen vastaavalla yhdisteellä, vetysulfidilla (H2S), ole vetysidoksia, ja vaikka sen molekyylipaino on kaksinkertainen veteen verrattuna, se on huoneenlämpötilassa kaasu. Vesimolekyylien välinen ylimääräinen sidos antaa myös nestemäiselle vedelle suuren ominaislämpökapasiteetin.
vetysidos aiheuttaa myös vesimolekyyleille epätavallista käyttäytymistä jäätyessään. Kuten useimmat muut materiaalit, neste tulee tiheämpi alentaa lämpötilaa. Toisin kuin useimmat muut aineet, kun ne jäähdytetään lähelle jäätymispistettä, vetysidosten läsnäolo merkitsee sitä, että molekyylit, kun ne järjestäytyvät uudelleen energiansa minimoimiseksi, muodostavat rakenteen, jonka tiheys on todellisuudessa pienempi: näin ollen kiinteä olomuoto, jää, kelluu vedessä. Toisin sanoen vesi laajenee jäätyessään (useimmat muut aineet kutistuvat jähmettyessään). Nestemäinen vesi saavuttaa suurimman tiheytensä 4 °C: n lämpötilassa.tällä on mielenkiintoinen seuraus vesielämälle talvella. Pinnalta jäähdytetty vesi muuttuu tiheämmäksi ja vajoaa muodostaen konvektiovirtauksia, jotka viilentävät koko vesistöä, mutta kun järviveden lämpötila nousee 4°C: een, pinnalla oleva vesi viilentyessään edelleen harvenee ja jää pintakerrokseksi, joka lopulta muodostaa jäätä. Koska tiheyden muutos estää kylmemmän veden konvektion alaspäin, talvella jäätyneen suuren vesistön vesi on suurimmaksi osaksi vielä nestemäistä 4°C: ssa jäisen pinnan alla, jolloin kalat selviävät hengissä. Tämä on yksi tärkeimmistä esimerkeistä hienosäädetyistä fysikaalisista ominaisuuksista, jotka tukevat elämää maapallolla, jota käytetään argumenttina antropiselle periaatteelle.
Toinen seuraus on, että jää sulaa, jos siihen kohdistuu riittävä paine.
veden ja jään rakenne
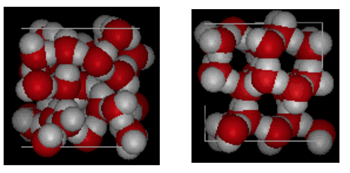
yllä on vierekkäin vertailu laatikko 10 Angstroms poikki. Se osoittaa selvästi, että jää vie enemmän tilaa, koska vetysidos, joka tapahtuu, kun tila muuttuu nesteestä kiinteäksi. Ice Ih: ssä jokainen vesi muodostaa neljä vetysidosta, joiden O—o-etäisyys lähimpään happinaapuriin on 2,76 Angstromia. Koska jään rakenne on järjestetty, tietyssä tilavuusalueella on vähemmän H20-molekyylejä.
vesi liuottimena
vesi on myös hyvä liuotin polaarisuutensa vuoksi. Veden liuotinominaisuudet ovat biologiassa elintärkeitä, koska monet biokemialliset reaktiot tapahtuvat vain vesiliuoksissa (esimerkiksi sytoplasmassa ja veressä tapahtuvat reaktiot). Lisäksi vettä käytetään biologisten molekyylien kuljettamiseen.
veteen joutuessaan ioninen tai polaarinen yhdiste on vesimolekyylien ympäröimä. Vesimolekyylien suhteellisen pieni koko tyypillisesti mahdollistaa sen, että monet vesimolekyylit ympäröivät yhtä liukoista molekyyliä. Veden osittain negatiiviset dipolit vetävät puoleensa positiivisesti varautuneita liuoksenosia ja päinvastoin positiivisille dipoleille.
yleisesti ioniset ja polaariset aineet, kuten hapot, Alkoholit ja suolat, liukenevat helposti veteen, ja ei-polaariset aineet kuten rasvat ja öljyt eivät. Nonpolaariset molekyylit pysyvät yhdessä vedessä, koska vesimolekyylien on energeettisesti suotuisampaa sitoutua vetyyn toisiinsa kuin sitoutua van der Waalsin vuorovaikutuksiin ei-polaaristen molekyylien kanssa.
esimerkki ioniliuoksesta on pöytäsuola; natriumkloridi, NaCl, jakautuu Na+ – kationeiksi ja Cl-anioneiksi, joita kaikkia ympäröivät vesimolekyylit. Tämän jälkeen ionit kulkeutuvat helposti pois kiteisestä hilastaan liuokseen. Esimerkki nonionisesta liuoksesta on pöytäsokeri. Veden dipolit vety sitoutuu sokerimolekyylin dipolaarisiin alueisiin ja antaa sen kulkeutua liuokseen.
koheesio ja pintajännitys
vahvat vetysidokset antavat vedelle suuren koheesion ja sitä kautta pintajännityksen. Tämä on ilmeistä, kun pieniä määriä vettä laitetaan liukumattomalle pinnalle ja vesi pysyy yhdessä pisaroina. Tämä ominaisuus on tärkeä, kun vettä kuljetetaan xylem ylös varret kasveissa; vahva intermolecular nähtävyyksiä pitää vesipatsaan yhdessä, ja estää jännitystä aiheuttama hikoilu vetää. Muilla nesteillä, joiden pintajännitys on pienempi, on suurempi taipumus ”repeytyä”, jolloin muodostuu tyhjiö-tai ilmataskuja ja ksyleemiastia tehdään toimintakyvyttömäksi.
johtokyky
puhdas vesi on itse asiassa hyvä eriste (huono johdin), eli se ei johda sähköä hyvin. Koska vesi on niin hyvä liuotin, siihen on kuitenkin usein liuennut jotain liuotinta, useimmiten suolaa. Jos vedessä on tällaisia epäpuhtauksia, se voi johtaa sähköä paljon paremmin, koska epäpuhtaudet, kuten suola, koostuvat vesiliuoksessa olevista vapaista ioneista, joiden avulla sähkövirta voi virrata.
elektrolyysi
vesi voidaan jakaa sen alkuaineisiin, vetyyn ja happeen, johtamalla sen läpi virta. Tätä prosessia kutsutaan elektrolyysiksi. Vesimolekyylit hajoavat luonnostaan H+ – ja OH-ioneiksi, jotka vetävät kohti katodia ja vastaavasti anodia. Katodilla kaksi H+ – Ionia poimii elektroneja ja muodostaa H2-kaasua. Anodilla neljä OH-Ionia yhdistyy ja vapauttaa O2-kaasua, molekyylivettä ja neljä elektronia. Syntyneet kaasut kuplivat pintaan, josta ne voidaan kerätä talteen.
reaktiivisuus
kemiallisesti vesi on amfoteerista: se voi toimia happona tai emäksenä. Toisinaan termiä hydroksihappo käytetään, kun vesi toimii happona kemiallisessa reaktiossa. PH: ssa 7 (neutraali) hydroksidi-ionien (OH -) konsentraatio on yhtä suuri kuin hydronium – (H3O+) tai vety-ionien (H+) konsentraatio. Jos tasapaino häiriintyy, liuoksesta tulee hapan (hydroniumionien suurempi konsentraatio) tai emäksinen (hydroksidi-ionien suurempi konsentraatio).
vesi voi toimia reaktioissa joko happona tai emäksenä. Brønsted-Lowryn järjestelmän mukaan happo määritellään lajiksi, joka luovuttaa reaktiossa protonin (h+ – ionin), ja emäkseksi, joka vastaanottaa protonin. Reagoidessaan vahvemman hapon kanssa vesi toimii emäksenä; reagoidessaan heikomman hapon kanssa se toimii happona. Esimerkiksi se saa h+ – ionin HCl: stä tasapainotilassa:
HCl + H2O – – – > H3O+ + Cl –
tässä vesi toimii emäksenä vastaanottamalla h + – ionin. Happo luovuttaa H+- ionin, ja myös vesi voi tehdä tämän, kuten reaktiossa ammoniakin kanssa, NH3:
NH3 + H2O- – -> NH4+ + OH –
pH käytännössä
teoriassa puhtaan veden pH on 7. Käytännössä puhdasta vettä on hyvin vaikea tuottaa. Vesi, joka jätetään alttiiksi ilmalle pitkäksi aikaa, liuottaa nopeasti hiilidioksidia muodostaen hiilihappoliuoksen, jonka rajoittava pH on ~5,7 (viite: Kendall, J. (1916), Journal of the American Chemical Society 38 (11): 2460-2466).
puhdistusvesi
puhdistettua vettä tarvitaan moniin teollisiin sovelluksiin sekä kulutukseen. Ihmiset tarvitsevat vettä, joka ei sisällä liikaa suolaa tai muita epäpuhtauksia. Yleisiä epäpuhtauksia ovat esimerkiksi kemikaalit tai haitalliset bakteerit. Jotkut liuokset ovat hyväksyttäviä ja jopa toivottavia koetun maun parantamiseksi. Juomakelpoista vettä kutsutaan juomavedeksi.
kuusi suosittua vedenpuhdistusmenetelmää ovat:
- suodatus: Vesi johdetaan seulan läpi, joka nappaa pieniä hiukkasia. Mitä tiukempi seulan verkko on, sitä pienempiä hiukkasten täytyy olla läpäistäkseen. Suodatus ei riitä veden täydelliseen puhdistamiseen, mutta se on usein välttämätön ensimmäinen askel, koska tällaiset hiukkaset voivat häiritä perusteellisempia puhdistusmenetelmiä.
- kiehuva: vettä kuumennetaan kiehumispisteeseensä niin kauan, että se inaktivoi tai tappaa huoneenlämpöisessä vedessä normaalisti elävät mikro-organismit. Alueilla, joilla vesi on ”kovaa” (sisältää liuenneita kalsiumsuoloja), kiehuminen hajottaa bikarbonaatti-ionin, jolloin osa (mutta ei kaikki) liuenneesta kalsiumista saostuu kalsiumkarbonaatiksi. Tämä on ns” turkis”, joka kerääntyy vedenkeitin elementtejä jne. kovilla vesialueilla. Kalsiumia lukuun ottamatta kiehuminen ei poista vesiliuoksia, joilla on korkeampi kiehumispiste kuin vedellä, ja itse asiassa lisää niiden pitoisuutta (koska osa vedestä häviää höyrynä)
- hiilen suodatus: Hiili, joka on valmistustapansa vuoksi pinta-alaltaan suuri hiilen muoto, adsorboi monia yhdisteitä, mukaan lukien joitakin myrkyllisiä yhdisteitä. Vesi johdetaan aktiivihiilen läpi tällaisten epäpuhtauksien poistamiseksi. Tätä menetelmää käytetään yleisimmin kotitalouksien vedensuodattimissa ja akvaarioissa. Kotitalouksien juomaveden suodattimet sisältävät joskus myös hopeaa, pieniä määriä hopeaioneja, joilla on bakterisidinen vaikutus.
- tislaus: tislaus tarkoittaa veden keittämistä vesihöyryn tuottamiseksi. Tämän jälkeen vesihöyry nousee jäähtyneelle pinnalle, jossa se voi tiivistyä takaisin nesteeksi ja tulla kerätyksi. Koska liuokset eivät normaalisti höyrysty, ne pysyvät kiehuvassa liuoksessa. Edes tislaus ei täysin puhdista vettä, koska epäpuhtaudet, joilla on samanlaiset kiehumispisteet ja pisarat höyryn mukana kulkeutuvaa vaporisoimatonta nestettä. 99,9-prosenttista puhdasta vettä saadaan kuitenkin tislaamalla.
- Käänteisosmoosi: epäpuhtaaseen liuokseen sovelletaan mekaanista painetta, joka pakottaa puhtaan veden puoliläpäisevän kalvon läpi. Termi on käänteisosmoosi, koska normaali osmoosi johtaisi puhtaan veden liikahtamiseen toiseen suuntaan laimentamaan epäpuhtauksia. Käänteisosmoosi on teoreettisesti perusteellisin suuren mittakaavan vedenpuhdistusmenetelmä, joskin täydellisiä puoliläpäiseviä kalvoja on vaikea luoda. vaihtokromatografiassa vesi johdetaan varautuneen hartsikolonnin läpi, jossa on sivuketjuja, jotka vangitsevat kalsium -, magnesium-ja muita raskasmetalli-ioneja. Monissa laboratorioissa tämä puhdistusmenetelmä on korvannut tislauksen, koska se tuottaa suuren määrän erittäin puhdasta vettä nopeammin ja vähemmällä energiankulutuksella kuin muut prosessit. Tällä tavoin puhdistettua vettä kutsutaan deionisoiduksi vedeksi.
veden tuhlaaminen
veden tuhlaaminen on veden väärinkäyttöä eli sen tarpeetonta käyttöä. Esimerkkinä voidaan mainita veden, erityisesti ihmisten juomavaatimusten mukaisesti puhdistetun veden, käyttö tarpeettomassa kastelussa. Myös kodeissa vesi voi mennä hukkaan, jos vessaa huuhdellaan turhaan tai säiliö vuotaa. Veden saastuminen voi olla suurin yksittäinen veden väärinkäyttö. Siinä määrin kuin saaste rajoittaa veden muuta käyttöä, siitä tulee resurssin haaskausta saastuttajalle koituvista hyödyistä riippumatta.
mytologia
vesi on yksi neljästä klassisesta alkuaineesta tulen, maan ja ilman ohella, ja sitä pidettiin yleis-eli kaikkeuden perusjuttuna. Vettä pidettiin kylmänä ja kosteana. Neljän ruumiin humuurin teoriassa vesi yhdistettiin limaan. Vesi oli myös yksi viidestä alkuaineesta kiinalaisessa taolaisuudessa maan, tulen, Puun ja metallin ohella.
Vesioikeudet ja kehitys
Unescon World Water Development Report (WWDR, 2003) sen World Water Assessment Program-ohjelmasta osoittaa, että seuraavan 20 vuoden aikana maailmassa on ennennäkemätön juomaveden puute. Kaikkien käytettävissä olevan veden määrän ennustetaan vähenevän 30 prosenttia. Syitä ovat saastuminen, ilmaston lämpeneminen ja poliittiset ongelmat. Yli 2,2 miljoonaa ihmistä kuoli vuonna 2000 sairauksiin, jotka liittyivät saastuneen veden kulutukseen. Vuonna 2004 brittiläinen hyväntekeväisyysjärjestö WaterAid kertoi, että lapsi kuolee 15 sekunnin välein helposti ehkäistävissä oleviin veteen liittyviin sairauksiin.Raportti osoittaa suuria maailmanlaajuisia eroja käytettävissä olevan veden raa ’ assa määrässä: Kuwaitin 10 m3: sta henkilöä kohti vuodessa Ranskan Guayanan 812,121 m3: een. Kuwaitin kaltaiset rikkaammat maat selviävät kuitenkin helpommin veden vähäisestä saatavuudesta. Yhdysvalloissa vesilaki jakautuu kahden oikeusopin kesken: vesioikeudet, joita käytetään itäisissä ja eteläisissä osavaltioissa, joissa on runsaasti vettä, ja appropriation doktriini (tai Colorado doktriini), jota käytetään kuivissa läntisissä osavaltioissa.