一般
水の固体状態は氷として知られています。 温度の単位(以前は摂氏、現在はケルビン)は、水の三重点、273.16K(0.01℃)と611.2Pa、固体、液体、気体の水が平衡状態で共存する温度と圧力で定義されています。 水は、ガラス状の氷、非結晶(ガラス状)、水の固体状態などの状態の形成を含むいくつかの非常に奇妙な行動を示す。
647Kを超える温度、22.064MPaを超える圧力では、水分子の集合体は、液体のようなクラスターが蒸気のような相の中に浮かぶ超臨界状態を想定しています。
液体の水路は、空気柱内の液体の水の量の尺度です。
水分子の双極子の性質
水分子の重要な特徴はその極性の性質です。 水分子は、先端に水素原子、頂点に酸素を有する角度を形成する。 酸素は水素よりも高い電気陰性度を有するので、酸素原子を有する分子の側は部分的な負電荷を有する。 このような電荷差を持つ分子は双極子と呼ばれます。 電荷の違いにより、水分子は互いに引き寄せられ(比較的正の領域は比較的負の領域に引き寄せられる)、他の極性分子に引き寄せられる。 この引力は水素結合として知られている。
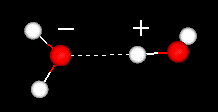 二つの水分子間の水素結合
二つの水分子間の水素結合
この比較的弱い(水分子自体内の共有結合に対して)引力は、分子間の水素結合を破壊するために多くの熱エネルギーが必要であるため、比較的高い沸点などの物理的性質をもたらす。 例えば、硫黄は周期律表の酸素以下の元素であり、その等価化合物である硫化水素(H2S)は水素結合を持たず、水の分子量は2倍であるが、室温ではガスである。 水分子間の余分結合はまた液体水に大きい比熱容量を与える。
水素結合はまた、凍結時に水分子に異常な挙動を与えます。 ちょうど他のほとんどの材料のように、液体は温度の低下とより密になります。 しかし、他のほとんどの材料とは異なり、凝固点付近に冷却すると、水素結合の存在は、分子がエネルギーを最小限に抑えるために再配置されると、実際には低密度の構造を形成することを意味します。 すなわち、水は凍ると同時に拡大します(他のほとんどの材料は凝固で縮まります)。 液体の水は4℃の温度で最高密度に達しますこれは冬の水の生活にとって興味深い結果をもたらします。 表面で冷却された水はより密度が高くなり、沈み、水体全体を冷却する対流流を形成するが、湖水の温度が4℃に達すると、表面の水はさらに冷えて密度が低くなり、最終的に氷を形成する表層として残る。 冷たい水の下向きの対流は密度の変化によってブロックされるので、冬に凍結した大きな水は、氷の表面の下で4℃でまだ液体の水の大部分を持ち、魚が生き残ることを可能にする。 これは、人類の原理の議論として使用されている地球上の生命を支える細かく調整された物理的性質の主要な例の一つです。
もう1つの結果は、十分な圧力が加われば氷が溶けてしまうということです。
水と氷の構造
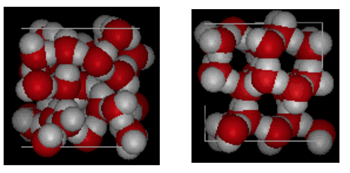
上に示されているのは、ボックス10オングストロームの横の比較です。 これは、状態が液体から固体に変化するときに起こる水素結合のために、氷がより多くのスペースを占めることを明確に示しています。 Ice Ihでは、各水は最も近い酸素の隣人に2.76オングストロームのO—O距離を持つ四つの水素結合を形成します。 氷の中の秩序構造のために、与えられた体積空間にはより少ないH20分子が存在する。
溶媒としての水
水は極性のために良好な溶媒でもあります。 多くの生化学反応は水溶液内でのみ起こるため、水の溶媒特性は生物学において不可欠である(例えば、細胞質および血液中の反応)。 さらに、水は生物学的分子を輸送するために使用される。
イオン性または極性化合物が水に入ると、水の分子に囲まれます。 水分子の比較的小さいサイズは、典型的には、多くの水分子が溶質の一つの分子を囲むことができます。 水の部分的に負の双極子は溶質の正に帯電した成分に引き付けられ、正の双極子についてはその逆もまた同様である。
一般に、酸、アルコール、塩などのイオン性物質や極性物質は水に溶けやすく、油脂などの非極性物質は溶けません。 非極性分子は、非極性分子とのファンデルワールス相互作用に関与するよりも、水分子が互いに水素結合することがエネルギー的により有利であるため、水
イオン溶質の一例は食塩であり、塩化ナトリウムであるNaClはNa+陽イオンとCl-陰イオンに分離し、それぞれが水分子で囲まれている。 イオンは結晶の格子から解決にそれから容易に運ばれます。 非イオン性溶質の例は、表糖である。 水は糖分子の双極子領域に水素結合を双極子し、それを溶液中に運び去ることを可能にする。
凝集力と表面張力
強い水素結合は水に高い凝集力を与え、結果的に表面張力を与えます。 これは、少量の水が非溶解性の表面に置かれ、水が滴として一緒にとどまるときに明らかである。 この特徴は植物の茎の上の木部を通って水が運ばれるとき重要です;強い分子間魅力は水コラムを一緒に握り、蒸散の引きによって引き起こされる張力 より低い表面張力を有する他の液体は、「裂ける」傾向が高く、真空またはエアポケットを形成し、木部容器を作動不能にする。
導電率
純水は実際には良い絶縁体(悪い導体)であり、電気をうまく伝導しないことを意味します。 しかし、水はそのような良好な溶媒であるため、多くの場合、溶質が溶解しており、最も頻繁には塩が含まれています。 水がそのような不純物を有するならば、塩のような不純物が電流を流すことができる水溶液中の遊離イオンを含むので、それははるかに良好に電
電気分解
水は、電流を流すことによって水素と酸素の構成要素に分割することができます。 このプロセスは電気分解と呼ばれます。 水分子は自然にh+とOH-イオンに解離し、それぞれ陰極と陽極に向かって引っ張られます。 陰極では、2つのH+イオンが電子を拾い、H2ガスを形成する。 陽極では、4つのOH-イオンが結合してO2ガス、分子水、および4つの電子を放出します。 ガスは、それらを収集することができる表面に気泡を生成しました。
反応性
化学的には、水は両性であり、酸または塩基として作用することができる。 水が化学反応の酸として機能するとき時折言葉の水酸化物酸は使用されます。 PH7(中性)では、水酸化物イオン(OH-)の濃度は、ヒドロニウム(H3O+)または水素イオン(H+)イオンの濃度に等しい。 平衡が乱されると、溶液は酸性(ハイドロニウムイオンの濃度が高い)または塩基性(水酸化物イオンの濃度が高い)になる。
水は、反応において酸または塩基のいずれかとして作用することができる。 Brønsted-Lowryシステムによれば、酸は反応中にプロトン(H+イオン)を供与する種として定義され、塩基はプロトンを受け取る種として定義される。 より強い酸と反応するとき、水は塩基として作用し、より弱い酸と反応するとき、それは酸として作用する。 例えば、それは平衡のHClからH+イオンを受け取ります:
HCl+H2O—>H3O++Cl-
ここで、水はH+イオンを受け取ることによって塩基として作用しています。 酸はH+イオンを供与し、アンモニアとの反応のように水もこれを行うことができます:
NH3+H2O—>NH4++OH-
実際にはpH
理論的には、純水のpHは7です。 実際には、純粋な水を生産することは非常に困難です。 任意の長さの時間のために空気にさらされたままの水は、急速に二酸化炭素を溶解し、〜5.7の制限pHで炭酸の溶液を形成する(参照:Kendall、J. ら(1 9 1 6),Journal o f the American Chemical Society3 8(1 1):2 4 6 0−2 4 6 6)。
精製水
精製水は、多くの産業用途や消費用途に必要です。 人間はあまりにも多くの塩や他の不純物が含まれていない水を必要とします。 一般的な不純物には、化学物質や有害な細菌が含まれます。 ある溶質は感知された好みの強化のために受諾可能、好ましいです。 飲用に適した水は飲用水と呼ばれます。
水を浄化するための六つの一般的な方法は次のとおりです:
- フィルタリング: 水は小さな粒子を捕らえるふるいに通されます。 ふるいのメッシュがきつくなればなるほど、粒子は通過する必要があります。 ろ過は水を完全に浄化するのに十分ではありませんが、そのような粒子はより徹底的な浄化方法を妨げる可能性があるため、しばしば必要な第一
- 沸騰:水は、室温で通常水中に生息する微生物を不活性化または死滅させるのに十分な長さ、その沸点まで加熱されます。 水が”硬い”(溶解したカルシウム塩を含む)領域では、沸騰は重炭酸イオンを分解し、溶解したカルシウムの一部(すべてではない)が炭酸カルシウムの形で沈殿する。 これは、ケトル要素などの上に蓄積する、いわゆる”毛皮”です。 硬水区域。 カルシウムを除いて、沸騰は水よりも沸点の高い溶質を除去せず、実際にはその濃度を増加させる(一部の水が蒸気として失われるため)
- 炭素ろ過: 木炭は、その調製様式のために高い表面積を有する炭素の一形態であり、いくつかの毒性化合物を含む多くの化合物を吸着する。 このような汚染物質を除去するために、水を活性炭に通す。 この方法は、家庭用浄水器や魚の水槽で最も一般的に使用されています。 飲料水用の家庭用フィルターには、銀、殺菌効果を有する微量の銀イオンも含まれていることがあります。
- 蒸留:蒸留には水を沸騰させて水蒸気を生成することが含まれます。 水蒸気は液体に戻って凝縮し、集めることができる冷却された表面にそれから上がります。 溶質は通常蒸発しないので、沸騰溶液中に残る。 蒸留であっても、同様の沸点を有する汚染物質および蒸気と共に運ばれる未蒸発液体の液滴のために、水を完全に浄化するわけではない。 しかし、99.9%の純水は蒸留によって得ることができる。
- 逆浸透:不純な溶液に機械的圧力をかけて、半透膜を通って純水を強制します。 通常の浸透は、不純物を希釈するために他の方向に移動する純粋な水をもたらすので、用語は逆浸透である。 完全な半permable膜が作成しにくいが逆浸透は理論的に利用できる大規模な浄水の最も完全な方法である。 交換クロマトグラフィー:この場合、水は、カルシウム、マグネシウム、および他の重金属イオンをトラップする側鎖を有する荷電樹脂カラムを通過する。 多くの実験室では、この精製方法は、他のプロセスよりも大量の非常に純粋な水をより迅速かつエネルギー使用量が少ないため、蒸留に取って代わ このようにして精製された水は脱イオン水と呼ばれます。
水を無駄にする
水を無駄にすることは、水の乱用、すなわち不必要に使用することです。 一例は、不必要な灌漑における水、特に人間の安全な飲用基準に精製された水の使用である。 また、家庭では、トイレが不必要に洗い流されたり、タンクが漏れたりすると、水が無駄になることがあります。 水を汚染させることは、水の最大の単一の乱用である可能性があります。 汚染物質が水の他の使用を制限する限り、汚染者への利益にかかわらず、それは資源の無駄になります。
神話
水は火、土、空気とともに四つの古典的な要素の一つであり、イレム、または宇宙の基本的なものとみなされていました。 水は冷たく湿っていたと考えられていた。 四つの身体ユーモアの理論では、水は痰と関連していた。 水は土、火、木、金属と並んで、中国の道教の五行の一つでもありました。
水の権利と開発
ユネスコの世界水評価プログラムによる世界水開発報告書(WWDR、2003)は、今後20年間で世界が前例のない飲料水の不足に直面している 誰もが利用できる水の量は30%減少すると予測されています。 原因は汚染、地球温暖化、政治的問題です。 汚染された水の消費に関連する病気から2.2万人以上が2000年に死亡した。 2004年、英国の慈善団体WaterAidは、子供が簡単に予防可能な水関連の病気のために15秒ごとに死ぬことを報告しました。この報告書は、利用可能な水の生の量に大きな世界的な格差を示しています:クウェートでは年間10m3からフランス領ギアナでは812.121m3まで。 しかし、クウェートのような豊かな国は、水の利用可能性が低いことにより、より簡単に対処できます。 アメリカ合衆国では、水法は二つの法的教義の間で分割されています: 豊かな水と乾燥した西部の州で使用される処分教義(またはコロラド-ドクトリン)がある東部と南部の州で使用される河岸の水の権利。