General
El estado sólido del agua se conoce como hielo; el estado gaseoso se conoce como vapor de agua (o vapor). Las unidades de temperatura (anteriormente el grado Celsius y ahora el Kelvin) se definen en términos del punto triple del agua, 273.16 K (0.01 °C) y 611.2 Pa, la temperatura y presión a la que el agua sólida, líquida y gaseosa coexisten en equilibrio. El agua exhibe algunos comportamientos muy extraños, incluida la formación de estados como hielo vítreo, un estado sólido no cristalino (vítreo) del agua.
A temperaturas superiores a 647 K y presiones superiores a 22,064 MPa, una colección de moléculas de agua asume una condición supercrítica, en la que los grupos similares a líquidos flotan dentro de una fase similar a vapor.
La trayectoria del agua líquida es una medida de la cantidad de agua líquida en una columna de aire.
La naturaleza dipolar de la molécula de agua
Una característica importante de la molécula de agua es su naturaleza polar. La molécula de agua forma un ángulo, con átomos de hidrógeno en las puntas y oxígeno en el vértice. Dado que el oxígeno tiene una electronegatividad más alta que el hidrógeno, el lado de la molécula con el átomo de oxígeno tiene una carga negativa parcial. Una molécula con tal diferencia de carga se llama dipolo. Las diferencias de carga hacen que las moléculas de agua se atraigan entre sí (las áreas relativamente positivas se atraen a las áreas relativamente negativas) y a otras moléculas polares. Esta atracción se conoce como enlace de hidrógeno.
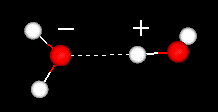 enlace de hidrógeno entre dos moléculas de agua
enlace de hidrógeno entre dos moléculas de agua
Esta atracción relativamente débil (en relación con los enlaces covalentes dentro de la molécula de agua en sí) resulta en propiedades físicas, como un punto de ebullición relativamente alto, porque se necesita mucha energía térmica para romper los enlaces de hidrógeno entre las moléculas. Por ejemplo, el azufre es el elemento debajo del oxígeno en la tabla periódica, y su compuesto equivalente, el sulfuro de hidrógeno (H2S) no tiene enlaces de hidrógeno, y aunque tiene el doble del peso molecular del agua, es un gas a temperatura ambiente. La unión adicional entre las moléculas de agua también le da al agua líquida una gran capacidad calorífica específica.
El enlace de hidrógeno también da a las moléculas de agua un comportamiento inusual al congelarse. Al igual que la mayoría de los otros materiales, el líquido se vuelve más denso al bajar la temperatura. Sin embargo, a diferencia de la mayoría de los otros materiales, cuando se enfrían cerca del punto de congelación, la presencia de enlaces de hidrógeno significa que las moléculas, a medida que se reorganizan para minimizar su energía, forman una estructura que en realidad es de menor densidad: por lo tanto, la forma sólida, el hielo, flotará en el agua. En otras palabras, el agua se expande a medida que se congela (la mayoría de los demás materiales se encogen al solidificarse). El agua líquida alcanza su mayor densidad a una temperatura de 4 °C. Esto tiene una consecuencia interesante para la vida acuática en invierno. El agua enfriada en la superficie se vuelve más densa y se hunde, formando corrientes de convección que enfrían todo el cuerpo de agua, pero cuando la temperatura del agua del lago alcanza los 4 ° C, el agua en la superficie, a medida que se enfría más, se vuelve menos densa y permanece como una capa superficial que eventualmente forma hielo. Dado que la convección hacia abajo del agua más fría está bloqueada por el cambio de densidad, cualquier cuerpo grande de agua congelada en invierno tendrá la mayor parte de su agua aún líquida a 4°C por debajo de la superficie helada, permitiendo que los peces sobrevivan. Este es uno de los principales ejemplos de propiedades físicas finamente ajustadas que apoyan la vida en la Tierra y que se usa como argumento para el principio antrópico.
Otra consecuencia es que el hielo se derretirá si se aplica suficiente presión.
Estructura de agua y Hielo
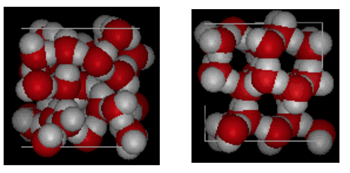
Arriba se muestra una comparación de lado a lado de una caja de 10 Angstroms de ancho. Muestra claramente que el hielo ocupa más espacio debido al enlace de hidrógeno que ocurre cuando el estado cambia de líquido a sólido. En ice Ih, cada agua forma cuatro enlaces de hidrógeno con distancias de O – – – O de 2,76 Angstroms al vecino de oxígeno más cercano. Debido a la estructura ordenada en el hielo, hay menos moléculas de H20 en un espacio de volumen dado.
Agua como disolvente
El agua también es un buen disolvente debido a su polaridad. Las propiedades de disolvente del agua son vitales en biología, porque muchas reacciones bioquímicas tienen lugar solo dentro de soluciones acuosas (por ejemplo, reacciones en el citoplasma y la sangre). Además, el agua se utiliza para transportar moléculas biológicas.
Cuando un compuesto iónico o polar entra en el agua, está rodeado de moléculas de agua. El tamaño relativamente pequeño de las moléculas de agua típicamente permite que muchas moléculas de agua rodeen una molécula de soluto. Los dipolos parcialmente negativos del agua son atraídos por componentes cargados positivamente del soluto, y viceversa para los dipolos positivos.
En general, las sustancias iónicas y polares como ácidos, alcoholes y sales son fácilmente solubles en agua, y las sustancias no polares como grasas y aceites no lo son. Las moléculas no polares permanecen juntas en el agua porque es energéticamente más favorable para que las moléculas de agua se unan de hidrógeno entre sí que para participar en interacciones de van der Waals con moléculas no polares.
Un ejemplo de soluto iónico es la sal de mesa; el cloruro de sodio, NaCl, se separa en cationes Na+ y aniones Cl, cada uno rodeado por moléculas de agua. Los iones son transportados fácilmente de su red cristalina a la solución. Un ejemplo de un soluto no iónico es el azúcar de mesa. Los dipolos de agua se unen a las regiones dipolares de la molécula de azúcar y permiten que se lleve a la solución.
Cohesión y tensión superficial
Los fuertes enlaces de hidrógeno dan al agua una alta cohesión y, en consecuencia, tensión superficial. Esto es evidente cuando se colocan pequeñas cantidades de agua en una superficie no soluble y el agua permanece unida como gotas. Esta característica es importante cuando el agua se transporta a través de tallos de xilema hacia arriba en las plantas; las fuertes atracciones intermoleculares mantienen unida la columna de agua y evitan la tensión causada por el tirón de la transpiración. Otros líquidos con menor tensión superficial tendrían una mayor tendencia a» rasgarse», formando bolsas de vacío o aire y dejando inoperativo el recipiente del xilema.
Conductividad
El agua pura es en realidad un buen aislante (conductor deficiente), lo que significa que no conduce bien la electricidad. Sin embargo, debido a que el agua es un solvente tan bueno, a menudo tiene algo de soluto disuelto en ella, la mayoría de las veces sal. Si el agua tiene tales impurezas, entonces puede conducir la electricidad mucho mejor, porque las impurezas como la sal comprenden iones libres en solución acuosa por los que puede fluir una corriente eléctrica.
Electrólisis
El agua se puede dividir en sus elementos constituyentes, hidrógeno y oxígeno, pasando una corriente a través de ella. Este proceso se llama electrólisis. Las moléculas de agua se disocian naturalmente en iones H + y OH -, que son atraídos hacia el cátodo y el ánodo, respectivamente. En el cátodo, dos iones H + recogen electrones y forman gas H2. En el ánodo, cuatro iones OH-se combinan y liberan gas O2, agua molecular y cuatro electrones. Los gases producidos burbujean a la superficie, donde pueden ser recogidos.
Reactividad
Químicamente, el agua es anfótera: capaz de actuar como ácido o base. Ocasionalmente, el término ácido hidroxico se usa cuando el agua actúa como un ácido en una reacción química. A un pH de 7 (neutro), la concentración de iones hidróxido (OH -) es igual a la de los iones hidronio (H3O+) o hidrógeno (H+). Si se altera el equilibrio, la solución se vuelve ácida (mayor concentración de iones hidronio) o básica (mayor concentración de iones hidróxido).
El agua puede actuar como un ácido o una base en las reacciones. Según el sistema Brønsted-Lowry, un ácido se define como una especie que dona un protón (un ion H+) en una reacción, y una base como una que recibe un protón. Cuando reacciona con un ácido más fuerte, el agua actúa como una base, al reaccionar con un ácido débil, actúa como un ácido. Por ejemplo, recibe un ion H + de HCl en el equilibrio:
HCl + H2O – – – > H3O + + Cl –
Aquí el agua actúa como base, al recibir un ion H+. Un ácido dona un ion H+, y el agua también puede hacer esto, como en la reacción con amoníaco, NH3:
NH3 + H2O —> NH4+ + OH-
pH En la práctica
En teoría, el agua pura tiene un pH de 7. En la práctica, el agua pura es muy difícil de producir. El agua que queda expuesta al aire durante cualquier período de tiempo disolverá rápidamente el dióxido de carbono, formando una solución de ácido carbónico, con un pH límite de ~5,7 (referencia: Kendall, J. (1916), Journal of the American Chemical Society 38 (11): 2460-2466).
Agua purificadora
El agua purificada es necesaria para muchas aplicaciones industriales, así como para el consumo. Los seres humanos necesitan agua que no contenga demasiada sal u otras impurezas. Las impurezas comunes incluyen productos químicos o bacterias dañinas. Algunos solutos son aceptables e incluso deseables para mejorar el sabor percibido. El agua apta para beber se denomina agua potable.
Seis métodos populares para purificar el agua son:
- Filtrado: El agua se pasa a través de un tamiz que atrapa pequeñas partículas. Cuanto más apretada sea la malla del tamiz, más pequeñas deben ser las partículas para pasar. El filtrado no es suficiente para purificar completamente el agua, pero a menudo es un primer paso necesario, ya que tales partículas pueden interferir con los métodos de purificación más completos.
- Ebullición: El agua se calienta a su punto de ebullición el tiempo suficiente para inactivar o matar microorganismos que normalmente viven en el agua a temperatura ambiente. En áreas donde el agua es «dura» (que contiene sales de calcio disueltas), la ebullición descompone el ion bicarbonato, lo que resulta en que parte (pero no todo) del calcio disuelto se precipite en forma de carbonato de calcio. Este es el llamado «pelaje»que se acumula en elementos de hervidor, etc. en zonas de aguas duras. Con la excepción del calcio, la ebullición no elimina los solutos de mayor punto de ebullición que el agua, y de hecho aumenta su concentración (debido a que se pierde algo de agua en forma de vapor)
- Filtración de carbono: El carbón vegetal, una forma de carbono con una gran superficie debido a su modo de preparación, absorbe muchos compuestos, incluidos algunos compuestos tóxicos. El agua se pasa a través del carbón activado para eliminar dichos contaminantes. Este método se usa más comúnmente en filtros de agua domésticos y peceras. Los filtros domésticos para agua potable a veces también contienen plata, trazas de iones de plata que tienen un efecto bactericida.
- Destilación: La destilación consiste en hervir el agua para producir vapor de agua. El vapor de agua luego se eleva a una superficie enfriada donde puede condensarse de nuevo en un líquido y recogerse. Debido a que los solutos normalmente no se vaporizan, permanecen en la solución hirviendo. Incluso la destilación no purifica completamente el agua, debido a contaminantes con puntos de ebullición similares y gotitas de líquido no evaporizado transportadas con el vapor. Sin embargo, el 99,9% de agua pura se puede obtener por destilación.
- Ósmosis inversa: Se aplica presión mecánica a una solución impura para forzar el agua pura a través de una membrana semipermeable. El término es ósmosis inversa, porque la ósmosis normal daría lugar a que el agua pura se moviera en la otra dirección para diluir las impurezas. La ósmosis inversa es teóricamente el método más completo de purificación de agua a gran escala disponible, aunque las membranas semipermibles perfectas son difíciles de crear. en la cromatografía de intercambio: En este caso, el agua se pasa a través de una columna de resina cargada que tiene cadenas laterales que atrapan el calcio, el magnesio y otros iones de metales pesados. En muchos laboratorios, este método de purificación ha reemplazado a la destilación, ya que proporciona un alto volumen de agua muy pura más rápidamente y con menos uso de energía que otros procesos. El agua purificada de esta manera se denomina agua desionizada.
Desperdicio de agua
El desperdicio de agua es el abuso del agua, es decir, su uso innecesario. Un ejemplo es el uso de agua, en particular agua purificada de acuerdo con las normas de consumo humano seguro, en el riego innecesario. Además, en los hogares, el agua puede desperdiciarse si el inodoro se descarga innecesariamente o si el tanque tiene fugas. Causar que el agua se contamine puede ser el mayor abuso individual de agua. En la medida en que un contaminante limita otros usos del agua, se convierte en un desperdicio del recurso, independientemente de los beneficios para el contaminador.
Mitología
El agua es uno de los cuatro elementos clásicos junto con el fuego, la tierra y el aire, y fue considerado como el ylem, o materia básica del universo. El agua se consideraba fría y húmeda. En la teoría de los cuatro humores corporales, el agua estaba asociada con la flema. El agua también era uno de los Cinco Elementos en el Taoísmo chino, junto con la tierra, el fuego, la madera y el metal.
Derechos sobre el agua y desarrollo
El Informe Mundial sobre el Desarrollo de los Recursos Hídricos de la UNESCO (WWDR, 2003) de su Programa Mundial de Evaluación de los Recursos Hídricos indica que en los próximos 20 años el mundo se enfrentará a una falta de agua potable sin precedentes. Se prevé que la cantidad de agua disponible para todos disminuya en un 30%. Las causas son la contaminación, el calentamiento global y los problemas políticos. Más de 2,2 millones de personas murieron en 2000 a causa de enfermedades relacionadas con el consumo de agua contaminada. En 2004, la organización benéfica británica WaterAid informó que un niño muere cada 15 segundos debido a enfermedades relacionadas con el agua que se pueden prevenir fácilmente.El informe indica grandes disparidades mundiales en el volumen bruto de agua disponible: de 10 m3 por persona y año en Kuwait a 812.121 m3 en la Guayana Francesa. Sin embargo, los países más ricos, como Kuwait, pueden hacer frente con mayor facilidad a la baja disponibilidad de agua. En los Estados Unidos, la ley de aguas se divide entre dos doctrinas jurídicas: derechos de agua ribereña, utilizados en los estados orientales y meridionales donde hay abundancia de agua y la doctrina de apropiación (o doctrina Colorado) utilizada en los estados occidentales áridos.