Généralités
L’état solide de l’eau est appelé glace; l’état gazeux est appelé vapeur d’eau (ou vapeur). Les unités de température (anciennement le degré Celsius et maintenant le Kelvin) sont définies en termes de point triple de l’eau, 273,16 K (0,01 ° C) et 611,2 Pa, la température et la pression auxquelles l’eau solide, liquide et gazeuse coexistent en équilibre. L’eau présente des comportements très étranges, y compris la formation d’états tels que la glace vitreuse, un état solide non cristallin (vitreux) de l’eau.
À des températures supérieures à 647 K et des pressions supérieures à 22,064 MPa, une collection de molécules d’eau suppose une condition supercritique, dans laquelle des amas de type liquide flottent dans une phase de type vapeur.
Le trajet de l’eau liquide est une mesure de la quantité d’eau liquide dans une colonne d’air.
La nature dipolaire de la molécule d’eau
Une caractéristique importante de la molécule d’eau est sa nature polaire. La molécule d’eau forme un angle, avec des atomes d’hydrogène aux extrémités et de l’oxygène au sommet. Puisque l’oxygène a une électronégativité plus élevée que l’hydrogène, le côté de la molécule avec l’atome d’oxygène a une charge négative partielle. Une molécule avec une telle différence de charge s’appelle un dipôle. Les différences de charge font que les molécules d’eau sont attirées les unes par les autres (les zones relativement positives étant attirées par les zones relativement négatives) et par d’autres molécules polaires. Cette attraction est connue sous le nom de liaison hydrogène.
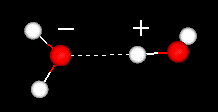 liaison hydrogène entre deux molécules d’eau
liaison hydrogène entre deux molécules d’eau
Cette attraction relativement faible (par rapport aux liaisons covalentes dans la molécule d’eau elle-même) se traduit par des propriétés physiques telles qu’un point d’ébullition relativement élevé, car beaucoup d’énergie thermique est nécessaire pour rompre les liaisons hydrogène entre les molécules. Par exemple, le soufre est l’élément en dessous de l’oxygène dans le tableau périodique, et son composé équivalent, le sulfure d’hydrogène (H2S) n’a pas de liaisons hydrogène, et bien qu’il ait deux fois le poids moléculaire de l’eau, c’est un gaz à température ambiante. La liaison supplémentaire entre les molécules d’eau confère également à l’eau liquide une grande capacité thermique spécifique.
La liaison hydrogène confère également aux molécules d’eau un comportement inhabituel lors de la congélation. Tout comme la plupart des autres matériaux, le liquide devient plus dense avec l’abaissement de la température. Cependant, contrairement à la plupart des autres matériaux, lorsqu’ils sont refroidis à un point de congélation proche, la présence de liaisons hydrogène signifie que les molécules, lorsqu’elles se réorganisent pour minimiser leur énergie, forment une structure qui est en fait de densité inférieure: d’où la forme solide, la glace, flottera dans l’eau. En d’autres termes, l’eau se dilate lorsqu’elle gèle (la plupart des autres matériaux se contractent lors de la solidification). L’eau liquide atteint sa densité la plus élevée à une température de 4 ° C. Cela a une conséquence intéressante pour la vie aquatique en hiver. L’eau refroidie à la surface devient plus dense et coule, formant des courants de convection qui refroidissent l’ensemble du plan d’eau, mais lorsque la température de l’eau du lac atteint 4 ° C, l’eau à la surface, à mesure qu’elle refroidit davantage, devient moins dense et reste sous forme de couche superficielle qui finit par former de la glace. Étant donné que la convection vers le bas des eaux plus froides est bloquée par le changement de densité, toute grande étendue d’eau gelée en hiver aura la majeure partie de son eau encore liquide à 4 ° C sous la surface glacée, permettant aux poissons de survivre. C’est l’un des principaux exemples de propriétés physiques finement ajustées qui soutiennent la vie sur Terre et qui est utilisé comme argument pour le principe anthropique.
Une autre conséquence est que la glace fondra si une pression suffisante est appliquée.
Structure de l’eau et de la glace
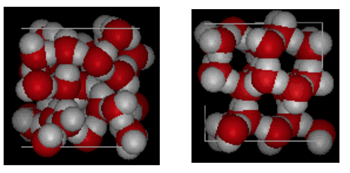
Ci-dessus est une comparaison côte à côte d’une boîte de 10 Angstroms à travers. Il montre clairement que la glace prend plus de place en raison de la liaison hydrogène qui se produit lorsque l’état passe du liquide au solide. Dans la glace Ih, chaque eau forme quatre liaisons hydrogène avec des distances O—O de 2,76 Angstroms au voisin d’oxygène le plus proche. En raison de la structure ordonnée dans la glace, il y a moins de molécules de H20 dans un espace de volume donné.
L’eau comme solvant
L’eau est également un bon solvant en raison de sa polarité. Les propriétés dissolvantes de l’eau sont vitales en biologie, car de nombreuses réactions biochimiques se produisent uniquement dans des solutions aqueuses (par exemple, des réactions dans le cytoplasme et le sang). De plus, l’eau est utilisée pour transporter des molécules biologiques.
Lorsqu’un composé ionique ou polaire pénètre dans l’eau, il est entouré de molécules d’eau. La taille relativement petite des molécules d’eau permet généralement à de nombreuses molécules d’eau d’entourer une molécule de soluté. Les dipôles partiellement négatifs de l’eau sont attirés par des composants chargés positivement du soluté, et vice versa pour les dipôles positifs.
En général, les substances ioniques et polaires telles que les acides, les alcools et les sels sont facilement solubles dans l’eau, et les substances non polaires telles que les graisses et les huiles ne le sont pas. Les molécules non polaires restent ensemble dans l’eau car il est énergétiquement plus favorable aux molécules d’eau de se lier d’hydrogène les unes aux autres que de s’engager dans des interactions de van der Waals avec des molécules non polaires.
Un exemple de soluté ionique est le sel de table; le chlorure de sodium, NaCl, se sépare en cations Na+ et anions Cl-, chacun étant entouré de molécules d’eau. Les ions sont ensuite facilement transportés loin de leur réseau cristallin en solution. Un exemple de soluté non ionique est le sucre de table. Les dipôles d’eau se lient en hydrogène aux régions dipolaires de la molécule de sucre et permettent de l’emporter en solution.
Cohésion et tension superficielle
Les fortes liaisons hydrogène confèrent à l’eau une cohésion élevée et, par conséquent, une tension superficielle. Cela est évident lorsque de petites quantités d’eau sont placées sur une surface non soluble et que l’eau reste ensemble sous forme de gouttes. Cette caractéristique est importante lorsque l’eau est transportée par le xylème jusqu’aux tiges des plantes; les fortes attractions intermoléculaires maintiennent la colonne d’eau ensemble et empêchent la tension causée par la traction par la transpiration. D’autres liquides avec une tension superficielle plus faible auraient une tendance plus élevée à « déchirer », formant des poches de vide ou d’air et rendant le vaisseau du xylème inopérant.
Conductivité
L’eau pure est en fait un bon isolant (mauvais conducteur), ce qui signifie qu’elle ne conduit pas bien l’électricité. Cependant, parce que l’eau est un bon solvant, elle contient souvent du soluté dissous, le plus souvent du sel. Si l’eau contient de telles impuretés, elle peut conduire beaucoup mieux l’électricité, car les impuretés telles que le sel comprennent des ions libres en solution aqueuse par lesquels un courant électrique peut circuler.
Électrolyse
L’eau peut être divisée en ses éléments constitutifs, l’hydrogène et l’oxygène, en y faisant passer un courant. Ce processus est appelé électrolyse. Les molécules d’eau se dissocient naturellement en ions H + et OH-, qui sont tirés vers la cathode et l’anode, respectivement. À la cathode, deux ions H+ captent des électrons et forment un gaz H2. À l’anode, quatre ions OH se combinent et libèrent du gaz O2, de l’eau moléculaire et quatre électrons. Les gaz produits bouillonnent à la surface, où ils peuvent être collectés.
Réactivité
Chimiquement, l’eau est amphotère : capable d’agir comme un acide ou une base. Parfois, le terme acide hydroxique est utilisé lorsque l’eau agit comme un acide dans une réaction chimique. À un pH de 7 (neutre), la concentration en ions hydroxyde (OH-) est égale à celle des ions hydronium (H3O+) ou hydrogène (H+). Si l’équilibre est perturbé, la solution devient acide (concentration plus élevée en ions hydronium) ou basique (concentration plus élevée en ions hydroxyde).
L’eau peut agir comme un acide ou une base dans les réactions. Selon le système de Brønsted-Lowry, un acide est défini comme une espèce qui donne un proton (un ion H +) dans une réaction, et une base comme une espèce qui reçoit un proton. Lorsqu’elle réagit avec un acide plus fort, l’eau agit comme une base; lorsqu’elle réagit avec un acide plus faible, elle agit comme un acide. Par exemple, il reçoit un ion H+ de HCl à l’équilibre:
HCl + H2O — > H3O ++ Cl –
Ici, l’eau agit comme une base, en recevant un ion H+. Un acide donne un ion H +, et l’eau peut également le faire, comme dans la réaction avec l’ammoniac, NH3:
NH3 + H2O — > NH4 + + OH –
pH en pratique
En théorie, l’eau pure a un pH de 7. En pratique, l’eau pure est très difficile à produire. L’eau laissée exposée à l’air pendant un certain temps dissoudra rapidement le dioxyde de carbone, formant une solution d’acide carbonique, avec un pH limite de ~ 5,7 (référence: Kendall, J. (1916), Journal de l’American Chemical Society 38 (11): 2460-2466).
Eau purifiante
L’eau purifiée est nécessaire pour de nombreuses applications industrielles, ainsi que pour la consommation. Les humains ont besoin d’eau qui ne contient pas trop de sel ou d’autres impuretés. Les impuretés courantes comprennent les produits chimiques ou les bactéries nocives. Certains solutés sont acceptables et même souhaitables pour une amélioration gustative perçue. L’eau potable est appelée eau potable.
Six méthodes populaires pour purifier l’eau sont:
- Filtrage: L’eau est passée à travers un tamis qui attrape les petites particules. Plus la maille du tamis est serrée, plus les particules doivent être petites pour passer. Le filtrage n’est pas suffisant pour purifier complètement l’eau, mais c’est souvent une première étape nécessaire, car de telles particules peuvent interférer avec les méthodes de purification les plus approfondies.
- Ébullition: L’eau est chauffée à son point d’ébullition assez longtemps pour inactiver ou tuer les micro-organismes qui vivent normalement dans l’eau à température ambiante. Dans les zones où l’eau est « dure » (contenant des sels de calcium dissous), l’ébullition décompose l’ion bicarbonate, ce qui entraîne la précipitation d’une partie (mais pas de la totalité) du calcium dissous sous forme de carbonate de calcium. C’est ce qu’on appelle la « fourrure » qui s’accumule sur des éléments de bouilloire, etc. dans les zones d’eau dure. À l’exception du calcium, l’ébullition n’élimine pas les solutés de point d’ébullition plus élevé que l’eau et augmente en fait leur concentration (en raison de la perte d’eau sous forme de vapeur)
- Filtration du carbone: Le charbon de bois, une forme de carbone à grande surface en raison de son mode de préparation, adsorbe de nombreux composés, y compris certains composés toxiques. L’eau passe à travers le charbon actif pour éliminer ces contaminants. Cette méthode est la plus couramment utilisée dans les filtres à eau ménagers et les aquariums. Les filtres ménagers pour l’eau potable contiennent parfois également de l’argent, des traces d’ions d’argent ayant un effet bactéricide.
- Distillation: La distillation consiste à faire bouillir l’eau pour produire de la vapeur d’eau. La vapeur d’eau monte ensuite sur une surface refroidie où elle peut se condenser en un liquide et être collectée. Comme les solutés ne sont normalement pas vaporisés, ils restent dans la solution bouillante. Même la distillation ne purifie pas complètement l’eau, en raison de contaminants ayant des points d’ébullition similaires et de gouttelettes de liquide non vaporisé transportées avec la vapeur. Cependant, l’eau pure à 99,9% peut être obtenue par distillation.
- Osmose inverse: Une pression mécanique est appliquée à une solution impure pour forcer l’eau pure à travers une membrane semi-perméable. Le terme est osmose inverse, car une osmose normale entraînerait un déplacement de l’eau pure dans l’autre sens pour diluer les impuretés. L’osmose inverse est théoriquement la méthode la plus complète de purification de l’eau à grande échelle disponible, bien que des membranes semi-permables parfaites soient difficiles à créer. lors de la chromatographie d’échange: Dans ce cas, l’eau passe à travers une colonne de résine chargée dotée de chaînes latérales qui emprisonnent le calcium, le magnésium et d’autres ions de métaux lourds. Dans de nombreux laboratoires, cette méthode de purification a remplacé la distillation, car elle fournit un volume élevé d’eau très pure plus rapidement et avec moins d’utilisation d’énergie que les autres procédés. L’eau ainsi purifiée est appelée eau désionisée.
Gaspiller de l’eau
Gaspiller de l’eau est l’abus d’eau, c’est-à-dire l’utiliser inutilement. Un exemple est l’utilisation de l’eau, en particulier de l’eau purifiée selon les normes de consommation humaine, pour l’irrigation inutile. De plus, dans les maisons, l’eau peut être gaspillée si les toilettes sont rincées inutilement ou si le réservoir fuit. La pollution de l’eau peut être le plus gros abus d’eau. Dans la mesure où un polluant limite d’autres utilisations de l’eau, il devient un gaspillage de la ressource, quels que soient les avantages pour le pollueur.
Mythologie
L’eau est l’un des quatre éléments classiques avec le feu, la terre et l’air, et était considérée comme le ylem, ou substance fondamentale de l’univers. L’eau était considérée comme froide et humide. Dans la théorie des quatre humeurs corporelles, l’eau était associée au flegme. L’eau était également l’un des Cinq éléments du taoïsme chinois, avec la terre, le feu, le bois et le métal.
Droits et développement de l’eau
Le Rapport Mondial sur la mise en valeur de l’eau de l’UNESCO (WWDR, 2003) issu de son Programme mondial d’évaluation de l’eau indique qu’au cours des 20 prochaines années, le monde fera face à un manque sans précédent d’eau potable. La quantité d’eau disponible pour tous devrait diminuer de 30%. Les causes sont la contamination, le réchauffement climatique et les problèmes politiques. Plus de 2,2 millions de personnes sont mortes en 2000 de maladies liées à la consommation d’eau contaminée. En 2004, l’organisation caritative britannique WaterAid a rapporté qu’un enfant meurt toutes les 15 secondes en raison de maladies liées à l’eau facilement évitables.Le rapport fait état de fortes disparités mondiales dans le volume brut d’eau disponible : de 10 m3 par personne et par an au Koweït à 812.121 m3 en Guyane française. Cependant, les pays plus riches comme le Koweït peuvent plus facilement faire face à une faible disponibilité en eau. Aux États-Unis, le droit de l’eau est divisé entre deux doctrines juridiques: droits d’eau riverains, utilisés dans les États de l’est et du sud où il y a une abondance d’eau et la doctrine d’appropriation (ou doctrine du Colorado) utilisée dans les États arides de l’Ouest.