General
starea solidă a apei este cunoscută sub numele de gheață; starea gazoasă este cunoscută sub numele de vapori de apă (sau abur). Unitățile de temperatură (anterior gradul Celsius și acum Kelvin) sunt definite în termeni de punct triplu de apă, 273,16 K (0,01 CTF C) și 611,2 Pa, temperatura și presiunea la care apa solidă, lichidă și gazoasă coexistă în echilibru. Apa prezintă unele comportamente foarte ciudate, inclusiv formarea de stări precum gheața vitroasă, o stare solidă (sticloasă), solidă a apei.
la temperaturi mai mari de 647 K și presiuni mai mari de 22.064 MPa, o colecție de molecule de apă presupune o stare supercritică, în care clusterele asemănătoare lichidului plutesc într-o fază asemănătoare vaporilor.
calea apei lichide este o măsură a cantității de apă lichidă dintr-o coloană de aer.
natura dipolară a moleculei de apă
o caracteristică importantă a moleculei de apă este natura sa polară. Molecula de apă formează un unghi, cu atomi de hidrogen la vârfuri și oxigen la vârf. Deoarece oxigenul are o electronegativitate mai mare decât hidrogenul, partea moleculei cu atomul de oxigen are o sarcină negativă parțială. O moleculă cu o astfel de diferență de încărcare se numește dipol. Diferențele de sarcină determină atragerea moleculelor de apă între ele (zonele relativ pozitive fiind atrase de zonele relativ negative) și de alte molecule polare. Această atracție este cunoscută sub numele de legături de hidrogen.
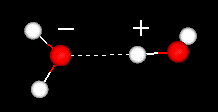 legătura de hidrogen între două molecule de apă
legătura de hidrogen între două molecule de apă
această atracție relativ slabă (în raport cu legăturile covalente din molecula de apă în sine) are ca rezultat proprietăți fizice, cum ar fi un punct de fierbere relativ ridicat, deoarece este necesară multă energie termică pentru a rupe legăturile de hidrogen dintre molecule. De exemplu, sulful este elementul de sub oxigen din tabelul periodic, iar compusul său echivalent, hidrogen sulfurat (H2S) nu are legături de hidrogen și, deși are de două ori greutatea moleculară a apei, este un gaz la temperatura camerei. Legătura suplimentară dintre moleculele de apă conferă, de asemenea, apei lichide o capacitate mare de căldură specifică.
legarea hidrogenului oferă, de asemenea, moleculelor de apă un comportament neobișnuit la îngheț. La fel ca majoritatea celorlalte materiale, lichidul devine mai dens odată cu scăderea temperaturii. Cu toate acestea, spre deosebire de majoritatea celorlalte materiale, atunci când sunt răcite până aproape de punctul de îngheț, prezența legăturilor de hidrogen înseamnă că moleculele, pe măsură ce se rearanjează pentru a-și minimiza energia, formează o structură care este de fapt de densitate mai mică: prin urmare, forma solidă, gheața, va pluti în apă. Cu alte cuvinte, apa se extinde pe măsură ce îngheață (majoritatea celorlalte materiale se micșorează la solidificare). Apa lichidă atinge cea mai mare densitate la o temperatură de 4 centi C. Acest lucru are o consecință interesantă pentru viața apei în timpul iernii. Apa răcită la suprafață devine mai densă și se scufundă, formând curenți de convecție care răcesc întregul corp de apă, dar când temperatura apei lacului atinge 4 centimetric C, apa de la suprafață, pe măsură ce se răcește în continuare, devine mai puțin densă și rămâne ca un strat de suprafață care în cele din urmă formează gheață. Deoarece convecția descendentă a apei mai reci este blocată de schimbarea densității, orice corp mare de apă înghețată în timpul iernii va avea cea mai mare parte a apei sale încă lichidă la 4 centimetrii C sub suprafața înghețată, permițând peștilor să supraviețuiască. Acesta este unul dintre principalele exemple de proprietăți fizice reglate fin care susțin viața pe Pământ, care este folosit ca argument pentru principiul antropic.
o altă consecință este că gheața se va topi dacă se aplică suficientă presiune.
structura apei și a gheții
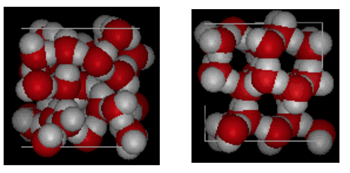
prezentat mai sus este o comparație una lângă alta a unei cutii de 10 angstromi peste. Arată clar că gheața ocupă mai mult spațiu din cauza legăturii de hidrogen care apare atunci când starea se schimbă de la lichid la solid. În gheață Ih, fiecare apă formează patru legături de hidrogen cu distanțe O—O de 2,76 angstromi până la cel mai apropiat vecin de oxigen. Datorită structurii ordonate în gheață există mai puține molecule de H20 într-un spațiu dat de volum.
apa ca solvent
apa este, de asemenea, un solvent bun datorită polarității sale. Proprietățile solventului apei sunt vitale în biologie, deoarece multe reacții biochimice au loc numai în soluții apoase (de exemplu, reacții în citoplasmă și sânge). În plus, apa este utilizată pentru transportul moleculelor biologice.
când un compus ionic sau polar intră în apă, acesta este înconjurat de molecule de apă. Dimensiunea relativ mică a moleculelor de apă permite de obicei multor molecule de apă să înconjoare o moleculă de solut. Dipolii parțial negativi ai apei sunt atrași de componentele încărcate pozitiv ale solutului și invers pentru dipolii pozitivi.
în general, substanțele ionice și polare, cum ar fi acizii, alcoolii și sărurile, sunt ușor solubile în apă, iar substanțele nepolare, cum ar fi grăsimile și uleiurile, nu. Moleculele nepolare rămân împreună în apă, deoarece este mai favorabil din punct de vedere energetic ca moleculele de apă să se lege între ele decât să se angajeze în interacțiunile van der Waals cu moleculele nepolare.
un exemplu de solut ionic este sarea de masă; clorura de sodiu, NaCl, se separă în cationi Na+ și anioni Cl, fiecare fiind înconjurat de molecule de apă. Ionii sunt apoi ușor transportați departe de rețeaua lor cristalină în soluție. Un exemplu de solut neionic este zahărul de masă. Dipolii de apă se leagă de regiunile dipolare ale moleculei de zahăr și îi permit să fie transportați în soluție.
coeziune și tensiune superficială
legăturile puternice de hidrogen conferă apei o coeziune ridicată și, în consecință, o tensiune superficială. Acest lucru este evident atunci când cantități mici de apă sunt puse pe o suprafață nesolubilă și apa rămâne împreună ca picături. Această caracteristică este importantă atunci când apa este transportată prin tulpini de xilem în plante; atracțiile intermoleculare puternice țin coloana de apă împreună și previn tensiunea cauzată de tragerea transpirației. Alte lichide cu tensiune superficială mai mică ar avea o tendință mai mare de a „rupe”, formând buzunare de vid sau aer și făcând vasul xilem inoperant.
conductivitate
apa pură este de fapt un bun izolator (conductor slab), ceea ce înseamnă că nu conduce bine electricitatea. Deoarece apa este un solvent atât de bun, cu toate acestea, are adesea un solut dizolvat în ea, cel mai frecvent sare. Dacă apa are astfel de impurități, atunci poate conduce electricitatea mult mai bine, deoarece impuritățile precum sarea cuprind ioni liberi în soluție apoasă prin care poate curge un curent electric.
electroliza
apa poate fi împărțită în elementele sale constitutive, hidrogen și oxigen, prin trecerea unui curent prin ea. Acest proces se numește electroliză. Moleculele de apă se disociază în mod natural în H+ și OH – ioni, care sunt trași spre catod și respectiv anod. La catod, doi ioni H + ridică electroni și formează gaz H2. La anod, patru ioni OH combină și eliberează gaz O2, apă moleculară și patru electroni. Gazele produse cu bule la suprafață, în cazul în care acestea pot fi colectate.
reactivitate
din punct de vedere chimic, apa este amfoterică: capabilă să acționeze ca acid sau bază. Ocazional, termenul de acid hidroxic este utilizat atunci când apa acționează ca un acid într-o reacție chimică. La un pH de 7 (neutru), concentrația ionilor de hidroxid (OH-) este egală cu cea a ionilor de hidroniu (H3O+) sau a ionilor de hidrogen (H+). Dacă echilibrul este perturbat, soluția devine acidă (concentrație mai mare de ioni de hidroniu) sau bazică (concentrație mai mare de ioni de hidroxid).
apa poate acționa fie ca un acid, fie ca o bază în reacții. Conform sistemului br-Lowry, un acid este definit ca o specie care donează un proton (un ion H+) într-o reacție și o bază ca una care primește un proton. Când reacționează cu un acid mai puternic, apa acționează ca bază; atunci când reacționează cu un acid mai slab, acționează ca un acid. De exemplu, primește un ion H+ de la HCl în echilibru:
HCl + H2O- – – > H3O+ + Cl-
aici apa acționează ca bază, primind un ion H+. Un acid donează un ion H+, iar apa poate face acest lucru, cum ar fi în reacția cu amoniacul, NH3:
NH3 + H2O —> NH4+ + OH-
pH în practică
în teorie, apa pură are un pH de 7. În practică, apa pură este foarte dificil de produs. Apa lăsată expusă la aer pentru orice perioadă de timp va dizolva rapid dioxidul de carbon, formând o soluție de acid carbonic, cu un pH limitativ de ~5,7 (referință: Kendall, J. (1916), Jurnalul Societății Americane de Chimie 38 (11): 2460-2466).
apă purificatoare
apa purificată este necesară pentru multe aplicații industriale, precum și pentru consum. Oamenii au nevoie de apă care nu conține prea multă sare sau alte impurități. Impuritățile obișnuite includ substanțe chimice sau bacterii dăunătoare. Unele substanțe dizolvate sunt acceptabile și chiar de dorit pentru îmbunătățirea gustului perceput. Apa care este potrivită pentru băut este denumită apă potabilă.
șase metode populare de purificare a apei sunt:
- filtrare: Apa este trecută printr-o sită care captează particule mici. Cu cât este mai strânsă plasa sitei, cu atât particulele trebuie să treacă mai mici. Filtrarea nu este suficientă pentru a purifica complet apa, dar este adesea un prim pas necesar, deoarece astfel de particule pot interfera cu metodele de purificare mai amănunțite.
- fierbere: apa este încălzită până la punctul său de fierbere suficient de mult pentru a inactiva sau ucide microorganismele care trăiesc în mod normal în apă la temperatura camerei. În zonele în care apa este „dură” (conținând săruri de calciu dizolvate), fierberea descompune ionul bicarbonat, rezultând precipitarea unora (dar nu a tuturor) calciului dizolvat sub formă de carbonat de calciu. Aceasta este așa-numita „blană” care se acumulează pe elementele fierbătorului etc. în zonele cu apă tare. Cu excepția calciului, fierberea nu elimină substanțele dizolvate cu un punct de fierbere mai mare decât apa și, de fapt, crește concentrația acestora (datorită pierderii unei cantități de apă sub formă de vapori)
- filtrarea carbonului: Cărbunele, o formă de carbon cu o suprafață mare datorită modului său de preparare, adsorbi mulți compuși, inclusiv unii compuși toxici. Apa este trecută prin cărbune activ pentru a elimina astfel de contaminanți. Această metodă este utilizată cel mai frecvent în filtrele de apă menajere și rezervoarele de pește. Filtrele de uz casnic pentru apa potabilă conțin uneori și argint, urme de ioni de argint care au un efect bactericid.
- distilare: distilarea implică fierberea apei pentru a produce vapori de apă. Vaporii de apă se ridică apoi la o suprafață răcită, unde se pot condensa înapoi într-un lichid și pot fi colectați. Deoarece substanțele dizolvate nu sunt în mod normal vaporizate, ele rămân în soluția de fierbere. Chiar și distilarea nu purifică complet apa, din cauza contaminanților cu puncte de fierbere similare și a picăturilor de lichid nevaporizat transportate cu aburul. Cu toate acestea, 99,9% apă pură poate fi obținută prin distilare.
- osmoză inversă: presiunea mecanică este aplicată unei soluții impure pentru a forța apa pură printr-o membrană semipermeabilă. Termenul este osmoză inversă, deoarece osmoza normală ar duce la mișcarea apei pure în cealaltă direcție pentru a dilua impuritățile. Osmoza inversă este teoretic cea mai amănunțită metodă de purificare a apei pe scară largă disponibilă, deși membranele semi-permabile perfecte sunt dificil de creat. la schimb cromatografie: în acest caz, apa este trecută printr-o coloană de rășină încărcată care are lanțuri laterale care captează calciu, magneziu și alți ioni de metale grele. În multe laboratoare, această metodă de purificare a înlocuit distilarea, deoarece oferă un volum mare de apă foarte pură mai rapid și cu un consum mai mic de energie decât alte procese. Apa purificată în acest fel se numește apă deionizată.
risipirea apei
risipirea apei este abuzul de apă, adică utilizarea inutilă a acesteia. Un exemplu este utilizarea apei, în special a apei purificate la standardele de băut în condiții de siguranță umană, în irigații inutile. De asemenea, în case, apa poate fi irosită dacă toaleta este spălată inutil sau rezervorul se scurge. Cauzarea apei pentru a deveni poluate poate fi cel mai mare abuz unic de apă. În măsura în care un poluant limitează alte utilizări ale apei, acesta devine o risipă a resursei, indiferent de beneficiile pentru poluator.
mitologie
apa este unul dintre cele patru elemente clasice, împreună cu focul, pământul și aerul, și a fost privit ca ylem, sau chestii de bază ale universului. Apa era considerată rece și umedă. În teoria celor patru umori corporale, apa a fost asociată cu flegma. Apa a fost, de asemenea, unul dintre cele cinci elemente din Taoismul Chinezesc, împreună cu Pământul, Focul, Lemnul și metalul.
drepturile și dezvoltarea apei
raportul UNESCO privind dezvoltarea Mondială a apei (WWDR, 2003) din programul său mondial de evaluare a apei indică faptul că în următorii 20 de ani lumea se confruntă cu o lipsă fără precedent de apă potabilă. Se estimează că cantitatea de apă disponibilă pentru toată lumea va scădea cu 30%. Cauzele sunt contaminarea, încălzirea globală și problemele politice. Peste 2,2 milioane de oameni au murit în 2000 din cauza bolilor legate de consumul de apă contaminată. În 2004, organizația de caritate WaterAid din Marea Britanie a raportat că un copil moare la fiecare 15 secunde din cauza bolilor legate de apă ușor de prevenit.Raportul indică disparități globale mari în volumul brut de apă disponibilă: de la 10 m3 pe persoană pe an în Kuweit la 812.121 m3 în Guyana Franceză. Cu toate acestea, țările mai bogate, cum ar fi Kuweitul, pot face față mai ușor disponibilității scăzute a apei. În Statele Unite, Legea apei este împărțită între două doctrine juridice: drepturile de apă riverane, utilizate în statele din est și sud, unde există o abundență de apă și doctrina de apropriere (sau doctrina Colorado) utilizată în statele occidentale aride.