Geral
O estado sólido da água é conhecido como gelo; o estado gasoso é conhecido como vapor de água (ou vapor). As unidades de temperatura (anteriormente o grau Celsius e agora o Kelvin) são definidas em termos do ponto triplo da água, 273,16 K (0,01 °C) e 611,2 Pa, a temperatura e pressão a que água sólida, líquida e gasosa coexistem em equilíbrio. A água exibe alguns comportamentos muito estranhos, incluindo a formação de estados como gelo vítreo, um estado sólido de água não-cristalino.
a temperaturas superiores a 647 K e pressões superiores a 22.064 MPa, uma coleção de moléculas de água assume uma condição supercrítica, na qual aglomerados de tipo líquido flutuam dentro de uma fase tipo vapor.
o caminho da água líquida é uma medida da quantidade de água líquida numa coluna de ar.
A natureza dipolar da molécula de água
Uma característica importante da molécula de água é a sua natureza polar. A molécula de água forma um ângulo, com átomos de hidrogênio nas pontas e oxigênio no vértice. Uma vez que o oxigênio tem uma eletronegatividade maior do que o hidrogênio, o lado da molécula com o átomo de oxigênio tem uma carga negativa parcial. Uma molécula com tal diferença de carga é chamada de dipolo. As diferenças de carga fazem com que as moléculas de água sejam atraídas umas para as outras (as áreas relativamente positivas sendo atraídas para as áreas relativamente negativas) e para outras moléculas polares. Esta atração é conhecida como ligação de hidrogênio.
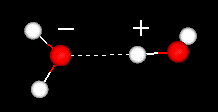 ligação de hidrogênio entre duas moléculas de água
ligação de hidrogênio entre duas moléculas de água
Este relativamente baixo (relativo ao ligações covalentes dentro da molécula de água em si) atração resultados de propriedades físicas, tais como relativamente elevado ponto de ebulição, porque uma grande quantidade de energia térmica é necessária para quebrar as ligações de hidrogénio entre as moléculas. Por exemplo, enxofre é o elemento abaixo do oxigênio na tabela periódica, e seu composto equivalente, sulfeto de hidrogênio (H2S) não tem ligações de hidrogênio, e embora tenha o dobro do peso molecular da água, é um gás à temperatura ambiente. A ligação extra entre moléculas de água também dá à água líquida uma grande capacidade térmica específica.
a ligação ao hidrogénio também dá às moléculas de água um comportamento invulgar quando congelam. Assim como a maioria dos outros materiais, o líquido torna-se mais denso com a diminuição da temperatura. No entanto, ao contrário da maioria dos outros materiais, quando arrefecidos até perto do ponto de congelação, a presença de ligações de hidrogénio significa que as moléculas, à medida que se reorganizam para minimizar a sua energia, formam uma estrutura que é na verdade de menor densidade: daí a forma sólida, o gelo, flutuará na água. Por outras palavras, a água expande-se à medida que congela (a maioria dos outros materiais encolhe na solidificação). A água líquida atinge a sua maior densidade a uma temperatura de 4 ° C. Isto tem uma consequência interessante para a vida da água no inverno. Água gelada na superfície torna-se mais densa e pias, formando correntes de convecção que legal toda a água do corpo, mas quando a temperatura da água do lago, atinge uma temperatura de 4°C, a água sobre a superfície, como calafrios além disso, torna-se menos densa, e permanece como uma camada de superfície que, eventualmente, formas de gelo. Uma vez que a convecção para baixo da água mais fria é bloqueada pela mudança de densidade, qualquer grande massa de água congelada no inverno terá a maior parte da sua água ainda líquida a 4°C abaixo da superfície gelada, permitindo que os peixes sobrevivam. Este é um dos principais exemplos de propriedades físicas finamente afinadas que suportam a vida na Terra que é usado como um argumento para o princípio antrópico.
outra consequência é que o gelo derreterá se for aplicada uma pressão suficiente.Estrutura da água e do Gelo
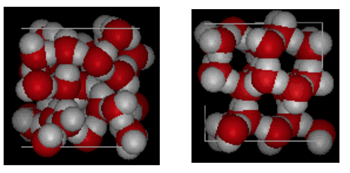
mostrados acima é uma comparação lado a lado de uma caixa 10 Angstroms através. Ele mostra claramente que o gelo ocupa mais espaço por causa da ligação de hidrogênio que ocorre quando o estado muda de líquido para sólido. No gelo Ih, cada Água Forma quatro ligações de hidrogênio com distâncias de o – – O de 2,76 Angstroms para o vizinho de oxigênio mais próximo. Devido à estrutura ordenada no gelo, há menos moléculas de H20 num dado espaço de volume.
a água como solvente
a água é também um bom solvente devido à sua polaridade. As propriedades solventes da água são vitais na biologia, porque muitas reações bioquímicas ocorrem apenas dentro de soluções aquosas (por exemplo, reações no citoplasma e sangue). Além disso, a água é usada para transportar moléculas biológicas.Quando um composto iónico ou polar entra na água, é rodeado por moléculas de água. O tamanho relativamente pequeno das moléculas de água normalmente permite que muitas moléculas de água rodeiem uma molécula de soluto. Os dipolos parcialmente negativos da água são atraídos por componentes positivamente carregados do soluto, e vice-versa para os dipolos positivos.
em geral, substâncias iônicas e polares como ácidos, álcoois e sais são facilmente solúveis em água, e substâncias não-polares como gorduras e óleos não são. As moléculas não-polares permanecem juntas na água porque é energeticamente mais favorável para as moléculas de água para se ligarem ao hidrogênio umas às outras do que para se engajar em interações de van der Waals com moléculas não-polares.
um exemplo de um soluto iónico é o sal de mesa; o cloreto de sódio, NaCl, separa – se em na+ catiões e Cl-aniões, cada um rodeado por moléculas de água. Os íons são então facilmente transportados para longe de sua estrutura cristalina em solução. Um exemplo de um soluto não-iónico é o açúcar de mesa. A água dipolo liga hidrogênio às regiões dipolares da molécula de açúcar e permite que ela seja levada para a solução.
coesão e tensão superficial
as fortes ligações de hidrogénio dão à água uma elevada coesão e, consequentemente, tensão superficial. Isto é evidente quando pequenas quantidades de água são colocadas numa superfície não-solúvel e a água permanece junta como gotas. Esta característica é importante quando a água é transportada através de caules xylem up em plantas; as fortes atrações intermoleculares mantêm a coluna de água unida, e prevenir a tensão causada pela atração transpiração. Outros líquidos com menor tensão superficial teriam uma maior tendência para” rasgar”, formando bolsas de vácuo ou ar e tornando o recipiente xylem inoperativo.
condutividade
a água pura é, na verdade, um bom isolador (condutor pobre), o que significa que não conduz bem a electricidade. Como a água é um solvente tão bom, no entanto, muitas vezes tem algum soluto dissolvido nela, mais frequentemente sal. Se a água tem tais impurezas, então ela pode conduzir a eletricidade muito melhor, porque impurezas como o sal compreendem íons livres em solução aquosa pela qual uma corrente elétrica pode fluir.
electrólise
a água pode ser dividida em seus elementos constituintes, hidrogênio e oxigênio, passando uma corrente através dela. Este processo é chamado de eletrólise. Moléculas de água naturalmente dissociam – se em h+ E OH-ions, que são puxados para o cátodo e ânodo, respectivamente. No cátodo, dois íons H+ captam elétrons e formam gás H2. No ânodo, quatro OH – ions se combinam e liberam gás O2, água molecular, e quatro elétrons. Os gases produziram bolha para a superfície, onde eles podem ser coletados.
reactividade
quimicamente, a água é anfotérica: capaz de actuar como um ácido ou base. Ocasionalmente, o termo ácido hidroxico é usado quando a água atua como um ácido em uma reação química. A um pH de 7 (neutro), a concentração de íons hidróxido (OH -) é igual à dos íons hidrônio (H3O+) ou hidrogênio (H+). Se o equilíbrio for perturbado, a solução torna-se ácida (maior concentração de íons hidrônio) ou básica (maior concentração de íons hidróxido).A água pode agir como um ácido ou uma base em reações. De acordo com o sistema Brønsted-Lowry, um ácido é definido como uma espécie que doa um próton (um íon H+) em uma reação, e uma base como uma que recebe um próton. Ao reagir com um ácido mais forte, a água atua como uma base; ao reagir com um ácido mais fraco, ela atua como um ácido. Por exemplo, recebe um íon H+ do HCl no equilíbrio:
HCl + H2O- – > H3O+ + Cl-
aqui a água está agindo como uma base, recebendo um íon H+. Um ácido doa um íon H+, e a água também pode fazer isso, como na reação com a amônia, NH3:
NH3 + H2O —> NH4+ + OH-
pH na Prática
Em teoria, a água pura tem um pH de 7. Na prática, a água pura é muito difícil de produzir. A água exposta ao ar durante qualquer período de tempo dissolve rapidamente o dióxido de carbono, formando uma solução de ácido carbónico, com um pH limitante de ~5.7 (referência: Kendall, J. (1916), Journal of the American Chemical Society 38 (11): 2460-2466).
Purificar a água
a água purificada é necessária para muitas aplicações industriais, bem como para consumo. Os seres humanos necessitam de água que não contenha muito sal ou outras impurezas. As impurezas comuns incluem produtos químicos ou bactérias nocivas. Alguns solutos são aceitáveis e até mesmo desejáveis para o aumento do gosto percebido. A água que é adequada para beber é denominada água potável.
seis métodos populares de purificação de água são::
- Filtragem: A água é passada através de uma peneira que captura pequenas partículas. Quanto mais apertada for a malha do peneiro, mais pequenas as partículas devem passar. Filtragem não é suficiente para purificar completamente a água, mas muitas vezes é um primeiro passo necessário, uma vez que tais partículas podem interferir com os métodos de purificação mais minuciosos.
- ebulição: a água é aquecida até ao seu ponto de ebulição o suficiente para inactivar ou matar microrganismos que normalmente vivem na água à temperatura ambiente. Em áreas onde a água é “dura” (contendo sais de cálcio dissolvidos), a ebulição decompõe o ião bicarbonato, resultando em alguns (mas não todos) do cálcio dissolvido sendo precipitado na forma de carbonato de cálcio. Este é o chamado “pêlo”que se acumula sobre elementos de chaleira etc. em áreas de água dura. Com exceção do cálcio, a ebulição não remove solutos de ponto de ebulição superior à água, e na verdade aumenta a sua concentração (devido à perda de alguma água como vapor)
- filtração de carbono: Carvão vegetal, uma forma de carbono com uma superfície elevada devido ao seu modo de preparação, adsorve muitos compostos, incluindo alguns compostos tóxicos. A água é passada através de carvão activado para remover tais contaminantes. Este método é mais comumente usado em Filtros de água domésticos e tanques de peixe. Os filtros domésticos para a água de beber às vezes também contêm prata, vestígios de íons de prata com um efeito bactericida. Destilação: A destilação envolve a ebulição da água para produzir vapor de água. O vapor de água sobe então para uma superfície fria, onde pode condensar-se num líquido e ser recolhido. Como os solutos não são normalmente vaporizados, eles permanecem na solução de ebulição. Mesmo a destilação não purifica completamente a água, por causa de contaminantes com pontos de ebulição semelhantes e gotículas de líquido não vaporizado transportado com o vapor. No entanto, 99,9% de água pura pode ser obtida por destilação. Osmose inversa: a pressão mecânica é aplicada a uma solução impura para forçar a água pura através de uma membrana semi-permeável. O termo é osmose reversa, porque osmose normal resultaria em água pura se movendo na outra direção para diluir as impurezas. A osmose reversa é teoricamente o método mais completo de purificação de água em larga escala disponível, embora membranas perfeitas semi-permáveis são difíceis de criar. em cromatografia de troca: neste caso, a água é passada através de uma coluna de resina carregada que tem cadeias laterais que retêm cálcio, magnésio e outros íons de metal pesado. Em muitos laboratórios, este método de purificação substituiu a destilação, uma vez que proporciona um elevado volume de água muito pura mais rapidamente e com menor consumo de energia do que outros processos. A água purificada desta forma é chamada de água desionizada.
desperdiçar água
desperdiçar água é o abuso da água, ou seja, usá-la desnecessariamente. Um exemplo é a utilização de água, em particular água purificada de acordo com os padrões humanos seguros de consumo, em irrigação desnecessária. Além disso, nas casas, a água pode ser desperdiçada se a sanita for despejada desnecessariamente ou o tanque vazar. Causar a poluição da água pode ser o maior abuso de água. Na medida em que um poluente limita outras utilizações da água, torna-se um desperdício do recurso, independentemente dos benefícios para o poluidor.A água é um dos quatro elementos clássicos juntamente com o fogo, a terra e o ar, e foi considerado como o ylem, ou material básico do universo. A água era considerada fria e úmida. Na teoria dos quatro humores corporais, a água foi associada com fleuma. A água também foi um dos cinco elementos do Taoísmo Chinês, juntamente com a terra, fogo, madeira e metal.
direitos e desenvolvimento da água
O Relatório Mundial de desenvolvimento da água da UNESCO (WWDR, 2003) do seu Programa Mundial de Avaliação da água indica que nos próximos 20 anos o mundo está enfrentando uma falta sem precedentes de água potável. Prevê-se que a quantidade de água disponível para todos diminua 30%. As causas são a contaminação, o aquecimento global e os problemas políticos. Mais de 2,2 milhões de pessoas morreram em 2000 devido a doenças relacionadas com o consumo de água contaminada. Em 2004, a instituição de caridade do Reino Unido WaterAid informou que uma criança morre a cada 15 segundos devido a doenças facilmente evitáveis relacionadas com a água.O relatório indica grandes disparidades globais no volume bruto de água disponível: de 10 m3 por pessoa e por ano no Kuwait para 812.121 m3 na Guiana Francesa. No entanto, países mais ricos como o Kuwait podem mais facilmente lidar com a baixa disponibilidade de água. Nos Estados Unidos a lei da água é dividida entre duas doutrinas legais: os direitos da água ribeirinhos, usados nos estados do leste e do Sul, onde há uma abundância de água e a doutrina de apropriação (ou Doutrina Colorado) usados nos estados ocidentais áridos.