Általános
a víz szilárd állapotát jégnek nevezik; a gázállapotot vízgőznek (vagy gőznek) nevezik. A hőmérséklet mértékegységeit (korábban a Celsius-fok, ma a Kelvin) a víz hármaspontjában, 273,16 K (0,01 Kb C) és 611,2 Pa-ban határozták meg, vagyis abban a hőmérsékletben és nyomásban, amelyen a szilárd, folyékony és gáznemű víz egyensúlyban van. A víz nagyon furcsa viselkedést mutat, beleértve az olyan állapotok kialakulását, mint az üveges jég, a nem kristályos (üveges), szilárd vízállapot.
647 K-nál nagyobb hőmérsékleten és 22,064 MPa-nál nagyobb nyomáson a vízmolekulák gyűjteménye szuperkritikus állapotot feltételez, amelyben a folyadékszerű klaszterek gőzszerű fázisban lebegnek.
a folyékony víz útja a levegőoszlopban lévő folyékony víz mennyiségének mértéke.
a vízmolekula dipoláris jellege
a vízmolekula fontos jellemzője a poláris jellege. A vízmolekula szöget képez, a hegyeken hidrogénatomok, a csúcson pedig oxigén található. Mivel az oxigén nagyobb elektronegativitással rendelkezik, mint a hidrogén, a molekula oxigénatommal rendelkező oldala részleges negatív töltéssel rendelkezik. Az ilyen töltéskülönbséggel rendelkező molekulát dipólusnak nevezzük. A töltéskülönbségek miatt a vízmolekulák vonzódnak egymáshoz (a viszonylag pozitív területek vonzódnak a viszonylag negatív területekhez) és más poláris molekulákhoz. Ezt a vonzerőt hidrogénkötésnek nevezik.
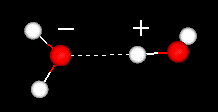 hidrogénkötés két vízmolekula között
hidrogénkötés két vízmolekula között
ez a viszonylag gyenge (a vízmolekulán belüli kovalens kötésekhez viszonyítva) vonzás fizikai tulajdonságokat eredményez, például viszonylag magas forráspontot, mert sok hőenergia szükséges a molekulák közötti hidrogénkötések megszakításához. Például a kén az oxigén alatti elem a periódusos rendszerben, és ekvivalens vegyülete, a hidrogén-szulfid (H2S) nem rendelkezik hidrogénkötésekkel, és bár kétszerese a víz molekulatömegének, szobahőmérsékleten gáz. A vízmolekulák közötti extra kötés a folyékony víz nagy fajlagos hőkapacitását is biztosítja.
a hidrogénkötés a vízmolekulák szokatlan viselkedését is eredményezi fagyasztáskor. Csakúgy, mint a legtöbb más anyag, a folyadék sűrűbbé válik a hőmérséklet csökkentésével. A legtöbb más anyaggal ellentétben azonban, amikor fagypont közelébe hűtik, a hidrogénkötések jelenléte azt jelenti, hogy a molekulák, miközben átrendeződnek az energiájuk minimalizálása érdekében, olyan szerkezetet alkotnak, amely valójában alacsonyabb sűrűségű: ezért a szilárd forma, jég, vízben úszik. Más szavakkal, a víz fagyáskor tágul (a legtöbb más anyag zsugorodik a megszilárduláskor). A folyékony víz legmagasabb sűrűségét 4 C. C. Ennek érdekes következménye van a téli vízéletre. A felszínen hűtött víz sűrűbbé válik, és süllyed, konvekciós áramokat képezve, amelyek lehűtik az egész víztestet, de amikor a tó vízének hőmérséklete eléri a 4-et (c), a víz a felszínen, ahogy tovább hűl, kevésbé sűrűvé válik, és felszíni rétegként marad, amely végül jeget képez. Mivel a hidegebb víz lefelé történő konvekcióját blokkolja a sűrűségváltozás, bármely télen fagyott nagy víztömeg vízének nagy része még mindig folyékony lesz 4CC a jeges felület alatt, lehetővé téve a halak túlélését. Ez az egyik legfontosabb példa a finoman hangolt fizikai tulajdonságokra, amelyek támogatják a földi életet, amelyet az antropikus elv érveként használnak.
egy másik következmény az, hogy a jég megolvad, ha elegendő nyomást gyakorolnak.
a víz és a jég szerkezete
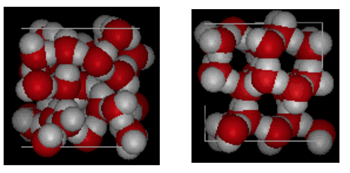
a fenti ábra egy doboz egymás melletti összehasonlítását mutatja 10 Angstromok át. Világosan mutatja, hogy a jég több helyet foglal el a hidrogénkötés miatt, amely akkor következik be, amikor az állapot folyadékról szilárdra változik. Az IH jégben minden víz négy hidrogénkötést képez O—O távolságokkal 2,76 Angström a legközelebbi oxigén szomszédhoz. A jég rendezett szerkezete miatt kevesebb H20 molekula van egy adott térfogattérben.
víz oldószerként
a víz polaritása miatt is jó oldószer. A víz oldószer tulajdonságai létfontosságúak a biológiában, mivel sok biokémiai reakció csak vizes oldatokban játszódik le (pl. a citoplazmában és a vérben). Ezenkívül a vizet biológiai molekulák szállítására használják.
amikor egy ionos vagy poláros vegyület vízbe kerül, vízmolekulák veszik körül. A vízmolekulák viszonylag kis mérete általában lehetővé teszi, hogy sok vízmolekula körülvegye az oldott anyag egy molekuláját. A víz részlegesen negatív dipólusai vonzódnak az oldott anyag pozitív töltésű komponenseihez, és fordítva a pozitív dipólusokhoz.
általában az ionos és poláros anyagok, például savak, alkoholok és sók könnyen oldódnak vízben, és a nem poláros anyagok, például zsírok és olajok nem. A nem poláros molekulák együtt maradnak a vízben, mert energetikailag kedvezőbb, ha a vízmolekulák hidrogénkötést kötnek egymással, mint ha van der Waals kölcsönhatásokat folytatnak a nem poláros molekulákkal.
az ionos oldott anyagra példa az asztali só; a nátrium – klorid, A NaCl, Na+ kationokra és Cl-anionokra válik szét, mindegyiket vízmolekulák veszik körül. Az ionokat ezután könnyen el lehet szállítani kristályrácsukból oldatba. A nemionos oldott anyagra példa az asztali cukor. A víz-dipólusok hidrogén kötődnek a cukormolekula dipoláris régióihoz, és lehetővé teszik, hogy oldatba kerüljön.
kohézió és felületi feszültség
az erős hidrogénkötések magas kohéziót és következésképpen felületi feszültséget adnak a víznek. Ez nyilvánvaló, ha kis mennyiségű vizet helyeznek egy nem oldódó felületre, és a víz cseppenként együtt marad. Ez a tulajdonság akkor fontos, ha a vizet a növényekben lévő szárakon keresztül szállítják; az erős intermolekuláris attrakciók együtt tartják a vízoszlopot, és megakadályozzák a transzpirációs húzás által okozott feszültséget. Más, alacsonyabb felületi feszültségű folyadékok hajlamosabbak a” rip ” – re, vákuumot vagy légzsebeket képezve, és a xylem-edény működésképtelenné válását.
vezetőképesség
a tiszta víz valójában jó szigetelő (rossz vezető), ami azt jelenti, hogy nem vezeti jól az áramot. Mivel a víz olyan jó oldószer, azonban gyakran van benne oldott anyag, leggyakrabban só. Ha a víz ilyen szennyeződésekkel rendelkezik, akkor sokkal jobban képes vezetni az áramot, mert a szennyeződések, például a só, szabad ionokat tartalmaznak vizes oldatban, amellyel elektromos áram áramolhat.
elektrolízis
a vizet alkotó elemeire, hidrogénre és oxigénre oszthatjuk úgy, hogy áramot vezetünk át rajta. Ezt a folyamatot elektrolízisnek nevezik. A vízmolekulák természetesen H+ és OH – ionokká válnak, amelyek a katód, illetve az anód felé húzódnak. A katódnál két H + ion veszi fel az elektronokat, és H2 gázt képez. Az anódnál négy OH-Ion kombinálódik és felszabadítja az O-T2 gáz, molekuláris víz és négy elektron. A keletkező gázok buborék a felszínre, ahol lehet gyűjteni.
reaktivitás
kémiailag a víz amfoter: képes savként vagy bázisként működni. Időnként a hidroxi-sav kifejezést akkor használják, amikor a víz savként működik egy kémiai reakcióban. 7 (semleges) pH-értéknél a hidroxidionok (OH-) koncentrációja megegyezik a hidrónium (H3O+) vagy hidrogénionok (H+) ionjaival. Ha az egyensúly megzavarodik, az oldat savas lesz (magasabb hidroniumion-koncentráció) vagy bázikus (magasabb hidroxid-ion-koncentráció).
a víz savként vagy bázisként működhet a reakciókban. A Br-Nsted-Lowry rendszer szerint a sav olyan faj, amely protont (H+ iont) adományoz egy reakcióban, a bázis pedig protont kap. Erősebb savval reagálva a víz bázisként működik, gyengébb savval reagálva savként működik. Például egy H+ iont kap HCl az egyensúlyban:
HCl + H2O —> H3O+ + Cl-
itt a víz bázisként működik, H+ ion fogadásával. Egy sav adományoz egy H + iont, és a víz is megteheti ezt, például ammóniával való reakcióban, NH3:
NH3 + H2O —> NH4+ + OH-
pH a gyakorlatban
elméletileg a tiszta víz pH-ja 7. A gyakorlatban a tiszta vizet nagyon nehéz előállítani. A levegőnek bármilyen ideig kitett víz gyorsan feloldja a szén-dioxidot, szénsavoldatot képezve, amelynek korlátozó pH-ja ~5,7 (hivatkozás: Kendall, J. (1916), Az Amerikai Kémiai Társaság folyóirata 38 (11): 2460-2466).
tisztító víz
tisztított vízre van szükség számos ipari alkalmazáshoz, valamint fogyasztásra. Az embereknek olyan vízre van szükségük, amely nem tartalmaz túl sok sót vagy más szennyeződést. A gyakori szennyeződések közé tartoznak a vegyi anyagok vagy a káros baktériumok. Néhány oldott anyag elfogadható, sőt kívánatos az érzékelt ízjavításhoz. Az ivásra alkalmas vizet ivóvíznek nevezzük.
hat népszerű módszer a víz tisztítására:
- szűrés: A vizet egy szitán vezetik át, amely apró részecskéket fog el. Minél szorosabb a szita hálója,annál kisebb részecskéknek kell áthaladniuk. A szűrés nem elegendő a víz teljes tisztításához, de gyakran szükséges első lépés, mivel az ilyen részecskék zavarhatják az alaposabb tisztítási módszereket.
- forráspont: a vizet elég hosszú ideig melegítik forráspontjáig ahhoz, hogy inaktiválják vagy elpusztítsák azokat a mikroorganizmusokat, amelyek általában szobahőmérsékleten vízben élnek. Azokon a területeken, ahol a víz “kemény”, (oldott kalciumsókat tartalmaz), a forralás lebontja a bikarbonát-iont, aminek eredményeként az oldott kalcium egy része (de nem az összes) kalcium-karbonát formájában kicsapódik. Ez az úgynevezett “szőr”, amely vízforraló elemekre épül stb. kemény vizes területeken. A kalcium kivételével a forráspont nem távolítja el a víznél magasabb forráspontú oldott anyagokat, sőt növeli azok koncentrációját (mivel néhány víz gőzként elvész)
- Szénszűrés: A faszén, a szén egyik formája, amelynek előállítási módja miatt nagy a felülete, sok vegyületet adszorbeál, beleértve néhány mérgező vegyületet is. A vizet aktív szénen vezetik át az ilyen szennyeződések eltávolítására. Ezt a módszert leggyakrabban háztartási vízszűrőkben és akváriumokban használják. Az ivóvízhez használt háztartási szűrők néha ezüstöt is tartalmaznak, nyomokban baktericid hatású ezüstionokat.
- desztillálás: a desztilláció során a vizet felforraljuk, hogy vízgőz keletkezzen. A vízgőz ezután egy lehűtött felületre emelkedik, ahol folyadékká kondenzálódhat és összegyűjthető. Mivel az oldott anyagok általában nem párolognak el, a forrásban lévő oldatban maradnak. Még a desztilláció sem tisztítja meg teljesen a vizet, mivel a hasonló forráspontú szennyeződések és a gőzzel szállított nem párologtatott folyadék cseppjei vannak. Desztillációval azonban 99,9% tiszta vizet lehet előállítani.
- fordított ozmózis: mechanikus nyomást gyakorolnak egy tisztátalan oldatra, hogy a tiszta vizet egy féligáteresztő membránon keresztül kényszerítsék. A kifejezés fordított ozmózis, mert a normál ozmózis azt eredményezné, hogy a tiszta víz a másik irányba mozog a szennyeződések hígításához. A fordított ozmózis elméletileg a rendelkezésre álló nagyszabású víztisztítás legalaposabb módszere, bár a tökéletes félig áteresztő membránokat nehéz létrehozni. csere kromatográfián: ebben az esetben a vizet egy töltött gyantaoszlopon vezetik át, amelynek oldalláncai vannak, amelyek csapdába ejtik a kalciumot, magnéziumés más nehézfém ionok. Sok laboratóriumban ez a tisztítási módszer felváltotta a desztillációt, mivel nagy mennyiségű nagyon tiszta vizet biztosít gyorsabban és kevesebb energiafelhasználással, mint más eljárások. Az így tisztított vizet ionmentesített víznek nevezzük.
vízpazarlás
a vízpazarlás a vízzel való visszaélés, azaz a víz felesleges használata. Példa erre a víz, különösen az emberi biztonságos ivási előírások szerint tisztított víz használata felesleges öntözésben. Az otthonokban a víz pazarolható, ha a WC-t feleslegesen öblítik, vagy a tartály szivárog. A víz szennyezettségének előidézése lehet a víz legnagyobb visszaélése. Amennyiben egy szennyező anyag korlátozza a víz egyéb felhasználását, az erőforrás pazarlásává válik, függetlenül a szennyező előnyeitől.
mitológia
a víz a négy klasszikus elem egyike a tűzzel, a földdel és a levegővel együtt, és az univerzum ylemjének, Vagyis alapvető anyagának tekintették. A vizet hidegnek és nedvesnek tartották. A négy testi humor elméletében a vizet a váladékkal társították. A víz a kínai Taoizmus öt elemének egyike volt, a föld, a tűz, a fa és a fém mellett.
Vízjogok és fejlesztés
az UNESCO Vízfejlesztési Világjelentése (WWDR, 2003) A Víz Világértékelési programjából azt jelzi, hogy a következő 20 évben a világ példátlan ivóvízhiánnyal néz szembe. A mindenki számára elérhető vízmennyiség várhatóan 30% – kal csökken. Ennek okai a szennyezés, a globális felmelegedés és a politikai problémák. Több mint 2,2 millió ember halt meg 2000-ben a szennyezett víz fogyasztásával kapcsolatos betegségek miatt. 2004-ben a WaterAid brit jótékonysági szervezet arról számolt be, hogy 15 másodpercenként meghal egy gyermek könnyen megelőzhető vízzel kapcsolatos betegségek miatt.A jelentés nagy globális különbségeket mutat a rendelkezésre álló víz nyers mennyiségében: Kuvaitban évente 10 m3-ről 812.121 m3-re francia Guyanában. A gazdagabb országok, például Kuvait azonban könnyebben megbirkózhatnak az alacsony vízellátással. Az Egyesült Államokban a vízjog két jogi doktrína között oszlik meg: a part menti vízjogok, amelyeket a keleti és déli államokban használnak, ahol rengeteg víz van, valamint a száraz nyugati államokban használt előirányzat-doktrína (vagy Colorado-doktrína).