Generelt
den faste tilstanden av vann er kjent som is; gassformen er kjent som vanndamp (eller damp). Temperaturenhetene (Tidligere Grad Celsius og Nå Kelvin) er definert i forhold til trippelpunktet av vann, 273,16 K (0,01 °C) og 611,2 Pa, temperaturen og trykket der fast, flytende og gassformig vann sameksisterer i likevekt. Vann viser noen veldig merkelige oppførsel, inkludert dannelsen av tilstander som glassaktig is, en ikke-krystallinsk (glassaktig), fast tilstand av vann.
ved temperaturer større enn 647 K og trykk større enn 22.064 MPa, antar en samling av vannmolekyler en superkritisk tilstand, hvor væskelignende klynger flyter i en damplignende fase.
den flytende vannbanen er et mål på mengden flytende vann i en luftkolonne.
vannmolekylets dipolare natur
et viktig trekk ved vannmolekylet er dets polare natur. Vannmolekylet danner en vinkel, med hydrogenatomer på spissene og oksygen ved toppunktet. Siden oksygen har en høyere elektronegativitet enn hydrogen, har siden av molekylet med oksygenatomet en delvis negativ ladning. Et molekyl med en slik ladningsforskjell kalles en dipol. Ladningsforskjellene fører til at vannmolekyler blir tiltrukket av hverandre (de relativt positive områdene blir tiltrukket av de relativt negative områdene) og til andre polare molekyler. Denne attraksjonen er kjent som hydrogenbinding.
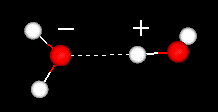 hydrogenbinding mellom to vannmolekyler
hydrogenbinding mellom to vannmolekyler
denne relativt svake (i forhold til de kovalente bindingene i selve vannmolekylet) tiltrekning resulterer i fysiske egenskaper som et relativt høyt kokepunkt, fordi mye varmeenergi er nødvendig for å bryte hydrogenbindingene mellom molekyler. For eksempel er svovel elementet under oksygen i det periodiske bordet, og dets ekvivalente forbindelse, hydrogensulfid (H2S), har ikke hydrogenbindinger, og selv om det har to ganger molekylvekten av vann, er det en gass ved romtemperatur. Den ekstra bindingen mellom vannmolekyler gir også flytende vann en stor spesifikk varmekapasitet.
hydrogenbinding gir også vannmolekyler en uvanlig oppførsel ved frysing. På samme måte som de fleste andre materialer blir væsken tettere med senketemperatur. Men i motsetning til de fleste andre materialer, når de avkjøles til nær frysepunkt, betyr tilstedeværelsen av hydrogenbindinger at molekylene, når de omarrangerer for å minimere sin energi, danner en struktur som faktisk har lavere tetthet: derfor vil den faste formen, is, flyte i vann. Med andre ord ekspanderer vannet når det fryser (de fleste andre materialer krymper ved størkning). Flytende vann når sin høyeste tetthet ved en temperatur på 4 °C. dette har en interessant konsekvens for vannlivet om vinteren. Vann kjølt på overflaten blir tettere og synker, danner konveksjonsstrømmer som avkjøler hele vannkroppen, men når temperaturen på innsjøvannet når 4°C, blir vann på overflaten, da det fryser videre, mindre tett og forblir som et overflatelag som til slutt danner is. Siden nedadgående konveksjon av kaldere vann er blokkert av tetthetsendringen, vil enhver stor vannkilde frosset om vinteren ha størstedelen av vannet fortsatt flytende ved 4°C under den isete overflaten, slik at fisken kan overleve. Dette er et av de viktigste eksemplene på finjusterte fysiske egenskaper som støtter livet på Jorden som brukes som et argument for det antropiske prinsippet.
en annen konsekvens er at isen smelter hvis tilstrekkelig trykk påføres.
Struktur Av Vann og Is
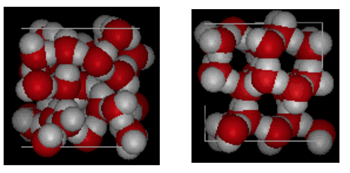
Vist ovenfor er en side ved side sammenligning av en boks 10 Ångstrøm over. Det viser tydelig at is tar opp mer plass på grunn av hydrogenbindingen som oppstår når tilstanden endres fra væske til fast stoff. I is Ih danner hvert vann fire hydrogenbindinger Med o – – – o avstander på 2, 76 Ångstrømmer til nærmeste oksygen nabo. På grunn av bestilt struktur i is er det mindre H20-molekyler i et gitt volumvolum.
Vann som løsemiddel
Vann er også et godt løsemiddel på grunn av sin polaritet. Løsningsmiddelegenskapene til vann er avgjørende i biologi, fordi mange biokjemiske reaksjoner bare finner sted i vandige løsninger (f.eks. reaksjoner i cytoplasma og blod). I tillegg brukes vann til å transportere biologiske molekyler.
når en ionisk eller polar forbindelse kommer inn i vann, er den omgitt av vannmolekyler. Den relativt små størrelsen på vannmolekyler tillater vanligvis mange vannmolekyler å omgir ett molekyl av løsemiddel. De delvis negative dipolene i vannet tiltrekkes av positivt ladede komponenter i løsningsmidlet, og omvendt for de positive dipolene.
generelt er ioniske og polare stoffer som syrer, alkoholer og salter lett oppløselige i vann, og ikke-polare stoffer som fett og oljer er ikke. Ikke-polare molekyler forblir sammen i vann fordi det er energisk gunstigere for vannmolekylene å hydrogenbinding til hverandre enn å engasjere seg i van Der Waals-interaksjoner med ikke-polare molekyler.
et eksempel på et ionisk løsemiddel er bordsalt; natriumkloridet, NaCl, separerer Seg I Na + kationer og Cl-anioner, hver omgitt av vannmolekyler. Ionene blir så lett transportert bort fra deres krystallinske gitter til løsning. Et eksempel på et ikke-ionisk løsemiddel er bordsukker. Vanndipolene hydrogenbindes til de dipolare områdene av sukkermolekylet og tillater det å bli båret bort i oppløsning.
Kohesjon og overflatespenning
de sterke hydrogenbindingene gir vann en høy kohesivitet og følgelig overflatespenning. Dette er tydelig når små mengder vann settes på en uoppløselig overflate og vannet forblir sammen som dråper. Denne funksjonen er viktig når vann føres gjennom xylem opp stammer i planter; de sterke intermolekylære attraksjoner holde vannsøylen sammen, og hindre spenning forårsaket av transpirasjon trekk. Andre væsker med lavere overflatespenning vil ha en høyere tendens til å «rive», danne vakuum-eller luftlommer og gjøre xylem-fartøyet ute av drift.
Konduktivitet
Rent vann er faktisk en god isolator( dårlig leder), noe som betyr at den ikke leder strøm godt. Fordi vann er et så godt løsemiddel, har det imidlertid ofte noe løsemiddel oppløst i det, oftest salt. Hvis vann har slike urenheter, kan det føre strøm mye bedre, fordi urenheter som salt omfatter frie ioner i vandig løsning som en elektrisk strøm kan strømme.
Elektrolyse
Vann kan deles inn i dets bestanddeler, hydrogen og oksygen, ved å føre en strøm gjennom den. Denne prosessen kalles elektrolyse. Vannmolekyler disassocierer naturlig i H + og OH – ioner, som trekkes mot henholdsvis katoden og anoden. Ved katoden plukker to H + – ioner opp elektroner og danner h2-gass. Ved anoden kombinerer fire OH – ioner og frigjør o2-gass, molekylært vann og fire elektroner. Gassene produsert boble til overflaten, hvor de kan samles.
Reaktivitet
Kjemisk er vann amfotert: i Stand til å fungere som en syre eller base. Av og til brukes begrepet hydroksinsyre når vann virker som en syre i en kjemisk reaksjon. Ved en pH på 7 (nøytral) er konsentrasjonen av hydroksidioner (OH -) lik den for hydronium (H3O+) eller hydrogenioner (H+) ioner. Hvis likevekten forstyrres, blir løsningen sur (høyere konsentrasjon av hydroniumioner) eller basisk (høyere konsentrasjon av hydroksydioner).
Vann kan virke som enten en syre eller en base i reaksjoner. Ifølge Brø-Lowry-systemet er en syre definert som en art som donerer et proton (en H+ ion) i en reaksjon, og en base som en som mottar et proton. Når man reagerer med en sterkere syre, virker vann som en base; når man reagerer med en svakere syre, virker den som en syre. For eksempel mottar Den En H + ion fra HCl i likevekten:
HCl + H2O – – – > H3O+ + Cl-
her fungerer vann som en base ved å motta En h + ion. En syre donerer En h+ ion, og vann kan også gjøre dette, FOR eksempel I reaksjonen med ammoniakk, NH3:
NH3 + H2O —> NH4+ + OH-
pH i Praksis
i teorien har rent vann en pH på 7. I praksis er rent vann svært vanskelig å produsere. Vann som blir utsatt for luft i lengre tid, vil raskt oppløse karbondioksid og danne en løsning av karbonsyre, med en begrensende pH på ~5,7 (referanse: Kendall, J. (1916), Journal Av American Chemical Society 38 (11): 2460-2466).
Rensende vann
Renset vann er nødvendig for mange industrielle applikasjoner, så vel som for forbruk. Mennesker trenger vann som ikke inneholder for mye salt eller andre urenheter. Vanlige urenheter inkluderer kjemikalier eller skadelige bakterier. Noen oppløsninger er akseptable og til og med ønskelige for oppfattet smakforbedring. Vann som er egnet for drikking kalles drikkevann.
Seks populære metoder for rensing av vann er:
- Filtrering: Vann føres gjennom en sik som fanger små partikler. Jo tettere siktens maske, desto mindre må partiklene passere gjennom. Filtrering er ikke tilstrekkelig til å fullstendig rense vann, men det er ofte et nødvendig første skritt, siden slike partikler kan forstyrre de grundigere rensemetoder.
- Kokende: Vann oppvarmes til kokepunktet lenge nok til å inaktivere eller drepe mikroorganismer som normalt lever i vann ved romtemperatur. I områder der vannet er «hardt» (som inneholder oppløste kalsiumsalter), dekomponerer kokende bikarbonationet, noe som resulterer i at noe (men ikke alt) av det oppløste kalsium utfelles i form av kalsiumkarbonat. Dette er den såkalte «pelsen»som bygger opp på kjeleelementer etc. i områder med hardt vann. Med unntak av kalsium fjerner koking ikke oppløsninger med høyere kokepunkt enn vann, og øker faktisk konsentrasjonen (på grunn av at noe vann går tapt som damp)
- Karbonfiltrering: Kull, en form for karbon med et høyt overflateareal på grunn av sin fremstillingsmåte, adsorberer mange forbindelser, inkludert noen giftige forbindelser. Vann føres gjennom aktivt kull for å fjerne slike forurensninger. Denne metoden er mest brukt i husholdningsvannfiltre og fisketanker. Husholdningsfiltre for drikkevann inneholder noen ganger også sølv, spormengder av sølvioner som har en bakteriedrepende effekt.
- Destillasjon: Destillasjon innebærer å koke vannet for å produsere vanndamp. Vanndampen stiger deretter til en avkjølt overflate hvor den kan kondensere tilbake til en væske og samles opp. Fordi oppløsningene ikke normalt fordampes, forblir de i kokende oppløsning. Selv destillasjon renser ikke helt vann, på grunn av forurensninger med lignende kokepunkter og dråper med uvaporisert væske som bæres med dampen. Imidlertid kan 99,9% rent vann oppnås ved destillasjon.
- Omvendt osmose: Mekanisk trykk påføres en uren løsning for å tvinge rent vann gjennom en semi-permeabel membran. Begrepet er omvendt osmose, fordi normal osmose vil resultere i rent vann som beveger seg i den andre retningen for å fortynne urenheter. Omvendt osmose er teoretisk den mest grundige metoden for storskala vannrensing tilgjengelig, selv om perfekte semi-permeable membraner er vanskelige å lage. på utvekslingskromatografi: i dette tilfellet føres vann gjennom en ladet harpikskolonne som har sidekjeder som fanger kalsium, magnesium og andre tungmetallioner. I mange laboratorier har denne rensemetoden erstattet destillasjon, da den gir et høyt volum veldig rent vann raskere og med mindre energiforbruk enn andre prosesser. Vann renset på denne måten kalles deionisert vann.
Å Kaste Bort Vann
Å Kaste bort vann er misbruk av vann, dvs. å bruke det unødvendig. Et eksempel er bruk av vann, spesielt vann renset til menneskelige trygge drikkestandarder, i unødvendig vanning. Også i boliger kan vann bli bortkastet hvis toalettet spyles unødvendig eller tanken lekker. Forårsaker vann å bli forurenset kan være den største enkelt misbruk av vann. I den grad et forurensende stoff begrenser annen bruk av vannet, blir det sløsing med ressursen, uavhengig av fordelene for forurenseren.
Mytologi
Vann er et av De fire klassiske elementene sammen med ild, jord og luft, og ble ansett som ylem, eller grunnleggende ting i universet. Vann ble ansett som kaldt og fuktig. I teorien om de fire kroppslige humørene var vann somforbundet med slim. Vann var også En Av De Fem Elementene I Kinesisk Taoisme, sammen med jord, ild, tre og metall.
vannrettigheter og utvikling
UNESCOS World Water Development Report (WWDR, 2003) fra World Water Assessment Program indikerer at i de neste 20 årene står verden overfor en enestående mangel på drikkevann. Mengden vann som er tilgjengelig for alle, forventes å redusere med 30%. Årsakene er forurensning, global oppvarming og politiske problemer. Mer enn 2,2 millioner mennesker døde i 2000 fra sykdommer knyttet til forbruk av forurenset vann. I 2004 rapporterte den britiske veldedighetsorganisasjonen WaterAid at et barn dør hvert 15. sekund på grunn av lett forebyggbare vannrelaterte sykdommer.Rapporten indikerer store globale forskjeller i råvolumet av tilgjengelig vann: fra 10 m3 per person per år I Kuwait til 812.121 m3 i fransk Guyana. Men rikere land som Kuwait kan lettere takle lav vanntilgjengelighet. I Usa vann loven er delt mellom to juridiske doktriner: riparian water rights, brukt i de østlige og sørlige statene der det er en overflod av vann og bevilgning doktrine (Eller Colorado doktrine) som brukes i de tørre vestlige statene.