Obecné
pevný stav vody je známý jako LED; plynný stav je známý jako vodní pára (nebo pára). Jednotky teploty (dříve stupně Celsia a teď, Kelvin) jsou definována na základě trojného bodu vody 273.16 K (0,01 °C) a 611.2 Pa, teplota a tlak, při kterém se pevné, kapalné a plynné voda koexistovat v rovnováze. Voda vykazuje některé velmi podivné chování, včetně tvorby stavů, jako je sklovitý LED, nekrystalický (skelný), pevný stav vody.
Při teplotách vyšších než 647 K a tlaky vyšší než 22.064 MPa, sbírka molekuly vody se předpokládá, že při nadkritickém stavu, ve kterém kapalina-jako shluky plavat do páru-jako fáze.
dráha kapalné vody je měřítkem množství kapalné vody ve sloupci vzduchu.
dipolární povaha molekuly vody
důležitým rysem molekuly vody je její polární povaha. Molekula vody tvoří úhel, s atomy vodíku na špičkách a kyslíkem na vrcholu. Protože kyslík má vyšší elektronegativitu než vodík, strana molekuly s atomem kyslíku má částečný záporný náboj. Molekula s takovým rozdílem náboje se nazývá dipól. Poplatek rozdíly způsobují, že molekuly vody přitahovány k sobě (relativně pozitivní oblasti, přitahuje relativně negativní oblastech) a jiných polárních molekul. Tato přitažlivost je známá jako vodíkové vazby.
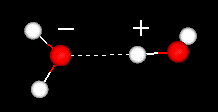 vodíkové vazby mezi dvěma molekulami vody
vodíkové vazby mezi dvěma molekulami vody
Tento relativně slabý (vzhledem k kovalentní vazby v molekule vody samotné) přitažlivost výsledky v takové fyzikální vlastnosti, jako relativně vysokým bodem varu, protože hodně tepelné energie je nezbytné k přerušení vodíkových vazeb mezi molekulami. Například, síra je prvek, pod kyslík v periodické tabulce, a jeho ekvivalent sloučenina, sirovodík (H2S) nemá vodíkové vazby, a i když to má dvojnásobnou molekulovou hmotnost vody, to je plyn při pokojové teplotě. Extra vazba mezi molekulami vody také dává kapalné vodě velkou měrnou tepelnou kapacitu.
vodíková vazba také dává molekulám vody neobvyklé chování při zmrazení. Stejně jako většina ostatních materiálů se kapalina při snižování teploty stává hustší. Nicméně, na rozdíl od většiny ostatních materiálů, když se ochladí na teplotu v blízkosti bodu mrazu, přítomnost vodíkových vazeb znamená, že molekuly, jako jsou uspořádání, aby se minimalizovaly jejich energie, tvoří strukturu, která je ve skutečnosti nižší hustota: proto pevné formě, led, bude plavat ve vodě. Jinými slovy, voda se při zamrznutí rozšiřuje(většina ostatních materiálů se při tuhnutí zmenšuje). Kapalná voda dosahuje nejvyšší hustoty při teplotě 4 °C. to má zajímavý důsledek pro život vody v zimě. Vodou chlazené na povrchu se stává hustší a dřezy, které tvoří konvekční proudy, které v pohodě celý vodní útvar, ale když teplota vody v jezeře dosáhne 4°C, voda na povrchu, jako je zimnice dále, se stává méně hustý, a zůstane jako povrchová vrstva, která nakonec tvoří led. Od sestupné proudění chladnější voda je blokován změnu hustoty, žádné velké množství vody, zmrazené v zimě bude mít většina jeho vody stále tekutý při teplotě 4°C pod ledovým povrchem, který umožňuje ryby přežít. To je jeden z hlavních příkladů jemně vyladěné fyzikální vlastnosti, které podporují život na Zemi, že je používán jako argument pro antropický princip.
dalším důsledkem je, že led se roztaví, pokud je aplikován dostatečný tlak.
struktura vody a ledu
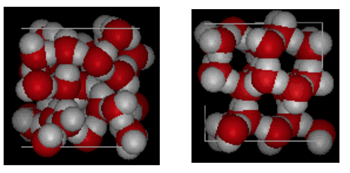
je uvedeno výše je vedle sebe srovnání boxu 10 Angstroms napříč. Jasně ukazuje, že LED zabírá více místa kvůli vodíkové vazbě, ke které dochází při změně stavu z kapaliny na pevnou látku. V ice Ih tvoří každá voda čtyři vodíkové vazby s O – – – O vzdálenostmi 2, 76 angstromů k nejbližšímu sousedovi kyslíku. Kvůli uspořádané struktuře v ledu je v daném prostoru objemu méně molekul H20.
voda jako rozpouštědlo
voda je také dobrým rozpouštědlem díky své polaritě. Vlastnosti rozpouštědla vody jsou životně důležité v biologii, protože mnoho biochemických reakcí probíhá pouze ve vodných roztocích (např. Kromě toho se voda používá k transportu biologických molekul.
když iontová nebo polární sloučenina vstoupí do vody, je obklopena molekulami vody. Relativně malá velikost molekul vody obvykle umožňuje mnoha molekulám vody obklopit jednu molekulu rozpuštěné látky. Částečně negativní dipóly vody jsou přitahovány k pozitivně nabitým složkám rozpuštěné látky a naopak k pozitivním dipólům.
obecně platí, iontové a polární látky, jako jsou kyseliny, alkoholy a soli jsou snadno rozpustné ve vodě a nepolární látky, jako jsou tuky a oleje nejsou. Nepolární molekuly zůstali pohromadě ve vodě, protože to je energeticky příznivější pro molekuly vody na vodík pouto k sobě, než aby se zapojily do van der Waalsovy interakce s nepolární molekuly.
příkladem iontové rozpuštěné látky je stolní sůl; chlorid sodný, NaCl, se odděluje na+ kationty a Cl-anionty, každý je obklopen molekulami vody. Ionty jsou pak snadno transportovány pryč od své krystalické mřížky do roztoku. Příkladem neiontové rozpuštěné látky je stolní cukr. Voda dipóly vodíkové vazby na dipolární oblasti molekuly cukru a nechte ji odvádět do roztoku.
soudržnost a povrchové napětí
silné vodíkové vazby dávají vodě vysokou soudržnost a následně povrchové napětí. To je zřejmé, když se malé množství vody umístí na nerozpustný povrch a voda zůstane pohromadě jako kapky. Tato funkce je důležitá, když vody se provádí přes xylem se stonky rostlin; silné mezimolekulární atrakce, držet vodní sloupec společně, a zabránit napětí způsobené transpirace vytáhnout. Jiné kapaliny s nižší povrchové napětí by mít vyšší tendenci „rip“, které tvoří vakuum nebo vzduchové kapsy a vykreslování xylem plavidla nefunkční.
vodivost
čistá voda je ve skutečnosti dobrý izolátor( špatný vodič), což znamená, že nevede elektřinu dobře. Protože voda je takové dobré rozpouštědlo, nicméně, často má rozpuštěnou rozpuštěnou látku, nejčastěji sůl. Pokud má voda takové nečistoty, může vést elektřinu mnohem lépe, protože nečistoty, jako je sůl, obsahují volné ionty ve vodném roztoku, kterým může proudit elektrický proud.
elektrolýza
voda může být rozdělena na její základní prvky, vodík a kyslík, průchodem proudem. Tento proces se nazývá elektrolýza. Molekuly vody se přirozeně disociují na ionty H+ a OH, které jsou přitahovány ke katodě a anodě. Na katodě dva ionty H+ zachycují elektrony a tvoří plyn H2. Na anodě, čtyři oh – ionty kombinují a uvolňují plyn O2, molekulární voda, a čtyři elektrony. Plyny produkované bubliny na povrch, kde mohou být shromažďovány.
reaktivita
chemicky je voda amfoterní: schopná působit jako kyselina nebo báze. Občas se termín kyselina hydroxová používá, když voda působí jako kyselina v chemické reakci. Při pH 7 (neutrální), koncentrace hydroxidových iontů (OH -), je rovna vodíku (H3O+) nebo vodíkových iontů (H+) ionty. Pokud je rovnováha narušena, roztok se stává kyselým (vyšší koncentrace hydroniových iontů) nebo zásaditým (vyšší koncentrace hydroxidových iontů).
voda může při reakcích působit buď jako kyselina, nebo jako báze. Podle systému Brønsted-Lowry je kyselina definována jako druh, který daruje proton (h + ion) v reakci, a báze jako ten, který přijímá proton. Při reakci se silnější kyselinou působí voda jako báze, při reakci se slabší kyselinou působí jako kyselina. Například přijímá h + ion z HCl v rovnováze:
HCl + H2O – – – > H3O+ + Cl –
zde voda působí jako báze přijímáním h + iontu. Kyselina daruje H+ iontů a vody, můžete také udělat, např. v reakci s amoniakem, NH3:
NH3 + H2O —> NH4+ + OH-
pH v Praxi
V teorii, čistá voda má pH 7. V praxi je výroba čisté vody velmi obtížná. Voda ponechaná na vzduchu po jakoukoli dobu rychle rozpustí oxid uhličitý a vytvoří roztok kyseliny uhličité s omezujícím pH ~5,7 (odkaz: Kendall, J. (1916), Journal of American Chemical Society 38 (11): 2460-2466).
čisticí voda
čištěná voda je potřebná pro mnoho průmyslových aplikací i pro spotřebu. Lidé potřebují vodu, která neobsahuje příliš mnoho soli nebo jiných nečistot. Mezi běžné nečistoty patří chemikálie nebo škodlivé bakterie. Některé rozpuštěné látky jsou přijatelné a dokonce žádoucí pro vnímané zlepšení chuti. Voda, která je vhodná k pití, se nazývá pitná voda.
šest populárních metod čištění vody je:
- filtrování: Voda prochází sítem, které zachycuje malé částice. Čím těsnější je síť síta, tím menší musí být částice projít. Filtrace nestačí k úplnému čištění vody, ale je to často nezbytný první krok, protože takové částice mohou interferovat s důkladnějšími metodami čištění.
- vaření: voda se zahřívá na teplotu varu dostatečně dlouho, aby inaktivovala nebo zabila mikroorganismy, které normálně žijí ve vodě při pokojové teplotě. V oblastech, kde je voda „tvrdá“, (obsahující rozpuštěné soli vápníku), s teplotou varu rozkládá sodný ion, což v některých (ale ne všechny) rozpuštěného vápníku, že se vysráží ve formě uhličitanu vápenatého. Jedná se o takzvanou „kožešinu“, která se staví na prvcích konvice atd. v oblastech s tvrdou vodou. S výjimkou vápníku, vroucí neodstraní rozpuštěných látek vyšší bod varu než voda, a ve skutečnosti zvyšuje jejich koncentrace (vzhledem k nějaké vodě se ztratil jako pára)
- Uhlíku, filtrování: Uhlí, forma uhlíku s vysokou povrchovou plochou díky způsobu přípravy, adsorbuje mnoho sloučenin, včetně některých toxických sloučenin. Voda prochází aktivním uhlím, aby se odstranily takové nečistoty. Tato metoda se nejčastěji používá v domácích vodních filtrech a nádržích na ryby. Domácí filtry pro pitnou vodu někdy také obsahují stříbro, stopové množství iontů stříbra, které mají baktericidní účinek.
- destilace: destilace zahrnuje vaření vody za vzniku vodní páry. Vodní pára pak stoupá na ochlazený povrch, kde může kondenzovat zpět do kapaliny a být shromažďována. Protože rozpuštěné látky nejsou normálně odpařovány, zůstávají ve vroucím roztoku. I destilace není zcela očistit vodou, protože kontaminujících látek s podobnými body varu a kapičky unvaporized kapaliny provádí s párou. 99,9% čisté vody však lze získat destilací.
- Reverzní osmóza: na nečistý roztok se aplikuje mechanický tlak, který nutí čistou vodu přes polopropustnou membránu. Termín je reverzní osmóza, protože normální osmózy by výsledek v čisté vodě pohybující se v opačném směru ke zředění nečistot. Reverzní osmóza je teoreticky nejdůkladnější metodou rozsáhlého čištění vody, i když je obtížné vytvořit dokonalé polopropustné membrány. na exchange chromatografie: V tomto případě, voda prochází nabitá pryskyřice sloupec, který má vedlejší řetězce, které past vápníku, hořčíku a dalších iontů těžkých kovů. V mnoha laboratořích tento způsob čištění nahradil destilaci, protože poskytuje vysoký objem velmi čisté vody rychleji as menší spotřebou energie než jiné procesy. Takto vyčištěná voda se nazývá deionizovaná voda.
plýtvání vodou
plýtvání vodou je zneužívání vody, tj. její zbytečné používání. Příkladem je použití vody, zejména vody čištěné podle lidských standardů bezpečného pití, při zbytečném zavlažování. Také v domácnostech může být voda zbytečná, pokud je toaleta zbytečně propláchnuta nebo nádrž uniká. Způsobení znečištění vody může být největším jediným zneužíváním vody. Pokud znečišťující látka omezuje jiné využití vody, stává se plýtváním zdrojem, bez ohledu na přínosy pro znečišťovatele.
mytologie
voda je jedním ze čtyř klasických prvků spolu s ohněm, zemí a vzduchem a byla považována za ylem nebo základní věci vesmíru. Voda byla považována za studenou a vlhkou. V teorii čtyř tělesných humorů byla voda spojena s hlenem. Voda byla také jedním z pěti prvků čínského taoismu, spolu se zemí, oheň, dřevo, a kov.
práva na Vodu a rozvoj
UNESCO World Water Development Report (WWDR, 2003) z jeho Svět Vody Hodnocení Programu, naznačuje, že v příštích 20 let, svět se potýká s bezprecedentní nedostatek pitné vody. Předpokládá se, že množství vody dostupné všem klesne o 30%. Příčiny jsou kontaminace, globální oteplování a politické problémy. Více než 2,2 milionu lidí zemřelo v roce 2000 na nemoci související se spotřebou kontaminované vody. V roce 2004 britská charitativní organizace WaterAid uvedla, že dítě umírá každých 15 sekund kvůli snadno preventivním onemocněním souvisejícím s vodou.Zpráva uvádí velké globální rozdíly v surovém objemu dostupné vody: od 10 m3 na osobu a rok v Kuvajtu po 812.121 m3 ve Francouzské Guyaně. Bohatší země, jako je Kuvajt, se však mohou snáze vyrovnat s nízkou dostupností vody. Ve Spojených státech je vodní právo rozděleno mezi dvě právní doktríny: pobřežní práva na vodu, používaná ve východních a jižních státech, kde je hojnost vody, a doktrína přivlastnění (nebo doktrína Colorado) používaná ve vyprahlých západních státech.