ogólne
stan stały wody jest znany jako lód; stan gazowy jest znany jako para wodna (lub para wodna). Jednostki temperatury (dawniej stopień Celsjusza, a obecnie Kelwin) są zdefiniowane w kategoriach punktu potrójnego wody, 273,16 K (0,01 °C) i 611,2 Pa, temperatury i ciśnienia, przy którym woda stała, ciekła i gazowa współistnieją w równowadze. Woda wykazuje pewne bardzo dziwne zachowania, w tym tworzenie się stanów, takich jak lód szklisty, niekrystaliczny (szklisty), stan stały wody.
w temperaturach większych niż 647 K i ciśnieniach większych niż 22,064 MPa, zbiór cząsteczek wody przyjmuje stan nadkrytyczny, w którym klastry podobne do cieczy pływają w fazie podobnej do pary.
ścieżka ciekłej wody jest miarą ilości ciekłej wody w kolumnie powietrza.
dipolarny charakter cząsteczki wody
ważną cechą cząsteczki wody jest jej polarny charakter. Cząsteczka wody tworzy kąt, z atomami wodoru na końcach i tlenem na wierzchołku. Ponieważ tlen ma wyższą elektroujemność niż wodór, strona cząsteczki z atomem tlenu ma częściowy ładunek ujemny. Cząsteczka o takiej różnicy ładunków nazywana jest dipolem. Różnice ładunków powodują przyciąganie cząsteczek wody do siebie (względnie dodatnie obszary są przyciągane do obszarów stosunkowo ujemnych) i do innych cząsteczek polarnych. To przyciąganie jest znane jako wiązanie wodorowe.
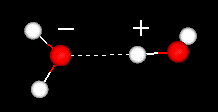 wiązanie wodorowe między dwiema cząsteczkami wody
wiązanie wodorowe między dwiema cząsteczkami wody
to stosunkowo słabe (w stosunku do wiązań kowalencyjnych w samej cząsteczce wody) przyciąganie skutkuje właściwościami fizycznymi, takimi jak stosunkowo wysoka temperatura wrzenia, ponieważ do zerwania wiązań wodorowych między cząsteczkami potrzebna jest duża ilość energii cieplnej. Na przykład siarka jest pierwiastkiem poniżej tlenu w układzie okresowym, a jej równoważny związek, siarkowodór (H2S) nie ma wiązań wodorowych i choć ma dwukrotnie większą masę cząsteczkową niż woda, jest gazem w temperaturze pokojowej. Dodatkowe wiązanie między cząsteczkami wody zapewnia również płynnej wodzie dużą pojemność cieplną właściwą.
wiązanie wodorowe nadaje również cząsteczkom wody niezwykłe zachowanie podczas zamrażania. Podobnie jak większość innych materiałów, ciecz staje się gęstsza wraz z obniżeniem temperatury. Jednak, w przeciwieństwie do większości innych materiałów, po schłodzeniu do temperatury bliskiej zamarznięciu, obecność wiązań wodorowych oznacza, że cząsteczki, gdy zmieniają swój układ, aby zminimalizować swoją energię, tworzą strukturę, która jest w rzeczywistości o niższej gęstości: stąd stała forma, lód, będzie unosić się w wodzie. Innymi słowy, woda rozszerza się, gdy zamarza (większość innych materiałów kurczy się podczas krzepnięcia). Płynna woda osiąga najwyższą gęstość w temperaturze 4 °C. Ma to interesujący wpływ na życie wody w zimie. Woda schłodzona na powierzchni staje się gęstsza i tonie, tworząc prądy konwekcyjne, które chłodzą cały zbiornik wodny, ale gdy temperatura wody jeziora osiąga 4°C, woda na powierzchni, gdy dalej chłodzi, staje się mniej gęsta i pozostaje jako warstwa powierzchniowa, która ostatecznie tworzy lód. Ponieważ konwekcja w dół zimniejszej wody jest zablokowana przez zmianę gęstości, każdy duży zbiornik wody zamrożonej w zimie będzie miał większość wody wciąż płynną w temperaturze 4°c pod lodowatą powierzchnią, pozwalając rybom przetrwać. Jest to jeden z głównych przykładów precyzyjnie dostrojonych właściwości fizycznych, które wspierają życie na Ziemi, który jest używany jako argument dla zasady antropicznej.
inną konsekwencją jest to, że lód topi się, jeśli zostanie zastosowane wystarczające ciśnienie.
struktura wody i lodu
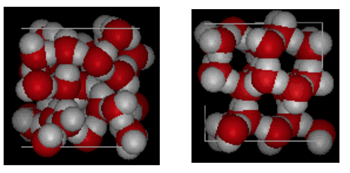
pokazane powyżej jest porównanie obok siebie z pola 10 Angstroms całej. Wyraźnie pokazuje, że lód zajmuje więcej miejsca z powodu wiązania wodorowego, które występuje, gdy stan zmienia się z ciekłego w stały. W lodzie IH każda woda tworzy cztery wiązania wodorowe O – – – O odległości 2,76 angstremów do najbliższego sąsiada tlenu. Ze względu na uporządkowaną strukturę w lodzie w danej przestrzeni objętości znajduje się mniej cząsteczek H20.
woda jako rozpuszczalnik
woda jest również dobrym rozpuszczalnikiem ze względu na jego polaryzację. Właściwości rozpuszczalnika wody są istotne w biologii, ponieważ wiele reakcji biochemicznych zachodzą tylko w roztworach wodnych (na przykład reakcje w cytoplazmie i krwi). Ponadto woda jest używana do transportu cząsteczek biologicznych.
kiedy jonowy lub polarny związek wchodzi do wody, jest otoczony przez cząsteczki wody. Stosunkowo mały rozmiar cząsteczek wody zazwyczaj pozwala wielu cząsteczkom wody otaczać jedną cząsteczkę substancji rozpuszczonej. Częściowo ujemne dipole wody są przyciągane do dodatnio naładowanych składników rozpuszczonego i odwrotnie dla dodatnich dipoli.
ogólnie rzecz biorąc, substancje jonowe i polarne, takie jak kwasy, alkohole i sole, są łatwo rozpuszczalne w wodzie, a substancje niepolarne, takie jak tłuszcze i oleje, nie są. Cząsteczki niepolarne pozostają razem w wodzie, ponieważ jest to energetycznie korzystniejsze dla cząsteczek wody do wiązania wodorowego ze sobą niż angażowanie się w interakcje van der Waalsa z cząsteczkami niepolarnymi.
przykładem jonowej substancji rozpuszczonej jest sól kuchenna; chlorek sodu, NaCl, dzieli się na kationy Na+ i CL-aniony, z których każdy jest otoczony cząsteczkami wody. Jony są następnie łatwo transportowane z ich sieci krystalicznej do roztworu. Przykładem niejonowej substancji rozpuszczalnej jest cukier stołowy. Woda dipoluje wiązanie wodorowe z regionami dipolarnymi cząsteczki cukru i pozwala na przeniesienie go do roztworu.
spójność i napięcie powierzchniowe
silne wiązania wodorowe dają wodzie wysoką spoistość, a co za tym idzie, napięcie powierzchniowe. Jest to widoczne, gdy małe ilości wody są umieszczane na nierozpuszczalnej powierzchni, a woda pozostaje razem jako krople. Ta cecha jest ważna, gdy woda jest przenoszona przez Xylem w górę łodyg w roślinach; silne międzycząsteczkowe atrakcje utrzymują razem słup wody i zapobiegają napięciu spowodowanemu ciągnięciem transpiracji. Inne ciecze o niższym napięciu powierzchniowym miały większą skłonność do” rozdarcia”, tworząc podciśnienie lub kieszenie powietrzne i unieruchamiając naczynie ksylema.
przewodność
czysta woda jest w rzeczywistości dobrym izolatorem (złym przewodnikiem), co oznacza, że nie przewodzi dobrze energii elektrycznej. Ponieważ woda jest tak dobrym rozpuszczalnikiem, często jednak rozpuszcza się w niej trochę substancji rozpuszczonej, najczęściej soli. Jeśli woda ma takie zanieczyszczenia, może przewodzić elektryczność znacznie lepiej, ponieważ zanieczyszczenia, takie jak sól, zawierają wolne jony w roztworze wodnym, przez które może przepływać prąd elektryczny.
elektroliza
wodę można podzielić na jej elementy składowe, wodór i tlen, przepuszczając przez nią prąd. Proces ten nazywa się elektrolizą. Cząsteczki wody naturalnie dysocjują do jonów H+ I OH -, które są przyciągane odpowiednio do katody i anody. Na katodzie dwa jony H+ pobierają elektrony i tworzą Gaz H2. Na anodzie cztery jony OH łączą się i uwalniają Gaz O2, wodę molekularną i cztery elektrony. Gazy produkowane pęcherzyków do powierzchni, gdzie mogą być zbierane.
reaktywność
chemicznie woda jest amfoteryczna: może działać jako kwas lub zasada. Czasami termin kwas hydroksylowy jest używany, gdy woda działa jako kwas w reakcji chemicznej. Przy pH 7 (obojętnym) stężenie jonów wodorotlenowych (OH-) jest równe stężeniu jonów hydroniowych (H3O+) lub wodorowych (H+). Jeśli równowaga jest zaburzona, roztwór staje się kwaśny (wyższe stężenie jonów hydroniowych) lub zasadowy (wyższe stężenie jonów wodorotlenowych).
woda może działać jako kwas lub zasada w reakcjach. Zgodnie z układem Brønsteda-Lowry ’ ego kwas definiuje się jako gatunek, który w reakcji oddaje proton (jon H+), A zasadę jako taki, który otrzymuje proton. W reakcji z silniejszym kwasem woda działa jak zasada; w reakcji ze słabszym kwasem działa jak kwas. Na przykład otrzymuje jon H+ z HCl w równowadze:
HCl + H2O – – – > H3O+ + Cl-
tutaj woda działa jako podstawa, otrzymując jon H+. Kwas przekazuje jon H+, a woda może również to zrobić, na przykład w reakcji z amoniakiem, NH3:
NH3 + H2O – – – > NH4 + + OH –
pH w praktyce
w teorii czysta woda ma pH 7. W praktyce czysta woda jest bardzo trudna do wytworzenia. Woda wystawiona na działanie powietrza przez dowolny okres czasu szybko rozpuszcza dwutlenek węgla, tworząc roztwór kwasu węglowego, o ograniczonym pH ~5,7 (odniesienie: Kendall, J. (1916), Journal of the American Chemical Society 38 (11): 2460-2466).
woda oczyszczająca
oczyszczona woda jest potrzebna do wielu zastosowań przemysłowych, a także do konsumpcji. Ludzie potrzebują wody, która nie zawiera zbyt dużo soli lub innych zanieczyszczeń. Typowe zanieczyszczenia obejmują chemikalia lub szkodliwe bakterie. Niektóre substancje rozpuszczalne są dopuszczalne, a nawet pożądane dla postrzeganego wzmocnienia smaku. Woda, która nadaje się do picia, nazywana jest wodą pitną.
sześć popularnych metod oczyszczania wody to:
- filtrowanie: Woda jest przepuszczana przez sito, które wychwytuje małe cząstki. Im mocniej siatka sita, tym mniejsze cząstki muszą przejść. Filtrowanie nie jest wystarczające do całkowitego oczyszczenia wody, ale często jest to konieczny pierwszy krok, ponieważ takie cząstki mogą zakłócać dokładniejsze metody oczyszczania.
- gotowanie: woda jest podgrzewana do temperatury wrzenia wystarczająco długo, aby dezaktywować lub zabić mikroorganizmy, które normalnie żyją w wodzie o temperaturze pokojowej. W obszarach, gdzie woda jest „twarda” (zawierająca rozpuszczone sole wapnia), gotowanie rozkłada jon wodorowęglanowy, powodując, że część (ale nie wszystkie) rozpuszczonego wapnia wytrąca się w postaci węglanu wapnia. Jest to tzw. „futro”, które buduje się na elementach czajnika itp. w obszarach o twardej wodzie. Z wyjątkiem wapnia, gotowanie nie usuwa substancji rozpuszczonych o wyższej temperaturze wrzenia niż woda, a w rzeczywistości zwiększa ich stężenie (z powodu utraty części wody jako pary)
- filtrowanie węglowe: Węgiel drzewny, forma węgla o dużej powierzchni ze względu na sposób przygotowania, adsorbuje wiele związków, w tym niektóre związki toksyczne. Woda jest przepuszczana przez węgiel aktywowany w celu usunięcia takich zanieczyszczeń. Metoda ta jest najczęściej stosowana w domowych filtrach do wody i akwariach. Filtry domowe do wody pitnej czasami zawierają również srebro, śladowe ilości jonów srebra o działaniu bakteriobójczym.
- destylacja: destylacja polega na zagotowaniu wody w celu wytworzenia pary wodnej. Para wodna następnie unosi się na schłodzoną powierzchnię, gdzie może skraplać się z powrotem do cieczy i zostać zebrana. Ponieważ substancje rozpuszczone nie są zwykle odparowywane, pozostają we wrzącym roztworze. Nawet destylacja nie oczyszcza całkowicie wody, ze względu na zanieczyszczenia o podobnych punktach wrzenia i kropelki nierozpuszczonej cieczy przenoszone z parą wodną. Jednak 99,9% czystej wody można uzyskać przez destylację.
- Odwrócona osmoza: ciśnienie mechaniczne jest stosowane do nieczystego roztworu, aby wymusić czystą wodę przez półprzepuszczalną membranę. Terminem tym jest odwrócona osmoza, ponieważ normalna osmoza spowodowałaby, że czysta woda poruszałaby się w innym kierunku, aby rozcieńczyć zanieczyszczenia. Odwrócona osmoza jest teoretycznie najdokładniejszą dostępną metodą oczyszczania wody na dużą skalę, chociaż doskonałe membrany półprzepuszczalne są trudne do stworzenia. w chromatografii wymiennej: w tym przypadku woda jest przepuszczana przez naładowaną kolumnę żywicy, która ma łańcuchy boczne, które zatrzymują jony wapnia, magnezu i innych metali ciężkich. W wielu laboratoriach ta metoda oczyszczania zastąpiła destylację, ponieważ zapewnia dużą objętość bardzo czystej wody szybciej i przy mniejszym zużyciu energii niż inne procesy. Woda oczyszczona w ten sposób nazywana jest wodą dejonizowaną.
marnowanie wody
marnowanie wody jest nadużywaniem wody, tj. niepotrzebnym jej używaniem. Przykładem jest wykorzystanie wody, w szczególności wody oczyszczonej zgodnie z normami bezpiecznego picia przez człowieka, do niepotrzebnego nawadniania. Ponadto w domach woda może zostać zmarnowana, jeśli toaleta zostanie niepotrzebnie spłukana lub zbiornik wycieka. Spowodowanie zanieczyszczenia wody może być największym pojedynczym nadużyciem wody. W takim stopniu, w jakim zanieczyszczenie ogranicza inne wykorzystanie wody, staje się ono marnotrawstwem zasobu, niezależnie od korzyści dla zanieczyszczającego.
mitologia
woda jest jednym z czterech klasycznych elementów obok ognia, ziemi i powietrza i była uważana za ylem, czyli podstawowe rzeczy wszechświata. Woda była zimna i wilgotna. W teorii czterech humorów cielesnych woda była powiązana z flegmą. Woda była również jednym z pięciu elementów w Chińskim taoizmie, obok Ziemi, Ognia, drewna i metalu.
prawa wodne i rozwój
Światowy raport UNESCO na temat rozwoju wody (WWDR, 2003) z jego Światowego Programu oceny wody wskazuje, że w ciągu najbliższych 20 lat świat stoi w obliczu bezprecedensowego braku wody pitnej. Przewiduje się, że ilość wody dostępnej dla wszystkich zmniejszy się o 30%. Przyczynami są zanieczyszczenia, globalne ocieplenie i problemy polityczne. Ponad 2,2 mln osób zmarło w 2000 roku na choroby związane ze spożyciem zanieczyszczonej wody. W 2004 roku brytyjska organizacja charytatywna WaterAid poinformowała, że dziecko umiera co 15 sekund z powodu łatwo zapobiegalnych chorób związanych z wodą.Raport wskazuje na duże globalne różnice w surowej objętości dostępnej wody: od 10 m3 na osobę rocznie w Kuwejcie do 812.121 m3 w Gujanie Francuskiej. Jednak bogatsze kraje, takie jak Kuwejt, mogą łatwiej poradzić sobie z niską dostępnością wody. W Stanach Zjednoczonych Prawo wodne dzieli się na dwie doktryny prawne: prawa wody łęgowej, stosowane we wschodnich i południowych stanach, gdzie występuje obfitość wody oraz Doktryna (lub Doktryna Kolorado) stosowana w suchych zachodnich Stanach.