allmänt
vattenets fasta tillstånd kallas is; gasformigt tillstånd kallas vattenånga (eller ånga). Temperaturenheterna (tidigare graden Celsius och nu Kelvin) definieras i termer av den tredubbla punkten för vatten, 273,16 K (0,01 kub C) och 611,2 Pa, temperaturen och trycket vid vilket fast, flytande och gasformigt vatten samexisterar i jämvikt. Vatten uppvisar några mycket konstiga beteenden, inklusive bildandet av tillstånd som glasartad is, ett icke-kristallint (glasartat), fast tillstånd av vatten.
vid temperaturer större än 647 K och tryck större än 22.064 MPa antar en samling vattenmolekyler ett superkritiskt tillstånd, i vilket vätskeliknande kluster flyter i en ångliknande fas.
den flytande vattenvägen är ett mått på mängden flytande vatten i en luftkolonn.
vattenmolekylens dipolära natur
en viktig egenskap hos vattenmolekylen är dess polära natur. Vattenmolekylen bildar en vinkel, med väteatomer vid spetsarna och syre vid vertexen. Eftersom syre har en högre elektronegativitet än väte, har sidan av molekylen med syreatomen en partiell negativ laddning. En molekyl med en sådan laddningsskillnad kallas en dipol. Laddningsskillnaderna gör att vattenmolekyler lockas till varandra (de relativt positiva områdena lockas till de relativt negativa områdena) och till andra polära molekyler. Denna attraktion är känd som vätebindning.
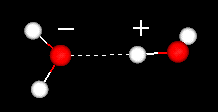 vätebindning mellan två vattenmolekyler
vätebindning mellan två vattenmolekyler
denna relativt svaga (relativt de kovalenta bindningarna i själva vattenmolekylen) attraktion resulterar i fysikaliska egenskaper såsom en relativt hög kokpunkt, eftersom mycket värmeenergi är nödvändig för att bryta vätebindningarna mellan molekyler. Till exempel är svavel elementet under syre i det periodiska systemet, och dess ekvivalenta förening, vätesulfid (H2S) har inte vätebindningar, och även om den har dubbelt så mycket vattenmolekylvikt är det en gas vid rumstemperatur. Den extra bindningen mellan vattenmolekyler ger också flytande vatten en stor specifik värmekapacitet.
vätebindning ger också vattenmolekyler ett ovanligt beteende vid frysning. Precis som de flesta andra material blir vätskan tätare med sänkningstemperaturen. Till skillnad från de flesta andra material, när de kyls till nära fryspunkt, innebär närvaron av vätebindningar att molekylerna, när de omarrangeras för att minimera sin energi, bildar en struktur som faktiskt har lägre densitet: därför kommer den fasta formen, isen, att flyta i vatten. Med andra ord expanderar vatten när det fryser (de flesta andra material krymper vid stelning). Flytande vatten når sin högsta densitet vid en temperatur av 4 kcal C. Detta har en intressant konsekvens för vattenlivet på vintern. Vatten kylt vid ytan blir tätare och sjunker och bildar konvektionsströmmar som kyler hela vattenkroppen, men när temperaturen på sjövattnet når 4 msk C blir vatten på ytan, när det fryser ytterligare, mindre tätt och förblir som ett ytskikt som så småningom bildar is. Eftersom nedåtgående konvektion av kallare vatten blockeras av densitetsförändringen, kommer alla stora vattenkroppar som fryses på vintern att ha huvuddelen av sitt vatten fortfarande flytande vid 4 kcal C under den isiga ytan, vilket gör att fisken kan överleva. Detta är ett av de viktigaste exemplen på finjusterade fysikaliska egenskaper som stöder livet på jorden som används som ett argument för den antropiska principen.
en annan konsekvens är att isen smälter om tillräckligt tryck appliceras.
struktur av vatten och is
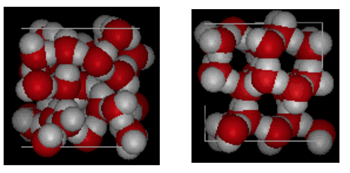
visas ovan är en sida vid sida jämförelse av en låda 10 Ångström över. Det visar tydligt att IS tar upp mer utrymme på grund av vätebindningen som uppstår när tillståndet ändras från vätska till fast ämne. I ice Ih bildar varje vatten fyra vätebindningar med O—O-avstånd på 2,76 Ångström till närmaste syregranne. På grund av ordnad struktur i IS finns det mindre H20-molekyler i ett givet volymutrymme.
vatten som lösningsmedel
vatten är också ett bra lösningsmedel på grund av dess polaritet. Vattnets lösningsmedelsegenskaper är viktiga i biologin, eftersom många biokemiska reaktioner endast äger rum inom vattenhaltiga lösningar (t.ex. reaktioner i cytoplasma och blod). Dessutom används vatten för att transportera biologiska molekyler.
när en jonisk eller polär förening kommer in i vatten omges den av vattenmolekyler. Den relativt lilla storleken på vattenmolekyler tillåter vanligtvis många vattenmolekyler att omge en molekyl löst ämne. De delvis negativa dipolerna i vattnet lockas till positivt laddade komponenter i det lösta ämnet och vice versa för de positiva dipolerna.
i allmänhet är joniska och polära ämnen som syror, alkoholer och salter lättlösliga i vatten, och icke-polära ämnen som fetter och oljor är det inte. Icke-polära molekyler stannar tillsammans i vatten eftersom det är energiskt mer gynnsamt för vattenmolekylerna till vätebindning till varandra än att engagera sig i van der Waals-interaktioner med icke-polära molekyler.
ett exempel på ett joniskt löst ämne är bordsalt; natriumkloriden, NaCl, separerar i Na+ katjoner och Cl – anjoner, var och en omges av vattenmolekyler. Jonerna transporteras sedan lätt bort från deras kristallina gitter till lösning. Ett exempel på ett nonjoniskt löst ämne är bordsocker. Vattendipolerna vätebindning till de dipolära regionerna i sockermolekylen och låter den transporteras bort i lösning.
sammanhållning och ytspänning
de starka vätebindningarna ger vatten en hög sammanhållning och följaktligen ytspänning. Detta är uppenbart när små mängder vatten läggs på en olöslig yta och vattnet förblir tillsammans som droppar. Denna funktion är viktig när vatten transporteras genom xylem upp stammar i växter; de starka intermolekylära attraktionerna håller vattenkolonnen ihop och förhindrar spänning orsakad av transpirationstryck. Andra vätskor med lägre ytspänning skulle ha en högre tendens att ”rippa”, bilda vakuum-eller luftfickor och göra xylemkärlet ur funktion.
ledningsförmåga
rent vatten är faktiskt en bra isolator (dålig ledare), vilket innebär att det inte leder elektricitet bra. Eftersom vatten är ett så bra lösningsmedel har det emellertid ofta något löst ämne upplöst i det, oftast salt. Om vatten har sådana föroreningar kan det leda elektricitet mycket bättre, eftersom föroreningar som salt innefattar fria joner i vattenlösning genom vilken en elektrisk ström kan strömma.
elektrolys
vatten kan delas upp i dess beståndsdelar, väte och syre, genom att passera en ström genom den. Denna process kallas elektrolys. Vattenmolekyler disassocierar naturligt i H + och OH – joner, som dras mot katoden respektive anoden. Vid katoden plockar två H + joner upp elektroner och bildar H2-gas. Vid anoden kombinerar fyra OH – joner och släpper ut O2-gas, molekylärt vatten och fyra elektroner. Gaserna producerade bubbla till ytan, där de kan samlas.
reaktivitet
kemiskt är vatten amfoter: kan fungera som en syra eller bas. Ibland används termen hydroxisyra när vatten fungerar som en syra i en kemisk reaktion. Vid ett pH av 7 (neutralt) är koncentrationen av hydroxidjoner (OH-) lika med den för hydronium (H3O+) eller vätejoner (H+) joner. Om jämvikten störs blir lösningen sur (högre koncentration av hydroniumjoner) eller basisk (högre koncentration av hydroxidjoner).
vatten kan fungera som antingen en syra eller en bas i reaktioner. Enligt Br-systemet definieras en syra som en art som donerar en proton (en h+ – Jon) i en reaktion och en bas som en som tar emot en proton. När man reagerar med en starkare syra fungerar vatten som en bas; när man reagerar med en svagare syra fungerar den som en syra. Till exempel får den en H + Jon från HCl i jämvikten:
HCl + H2O – – – > H3O+ + Cl-
här fungerar vatten som en bas genom att ta emot en h+ Jon. En syra donerar en h + Jon, och vatten kan också göra detta, såsom i reaktionen med ammoniak, NH3:
NH3 + H2O —> NH4+ + OH-
pH i praktiken
i teorin har rent vatten ett pH på 7. I praktiken är rent vatten mycket svårt att producera. Vatten som lämnas utsatt för luft under vilken tid som helst kommer snabbt att lösa upp koldioxid och bilda en lösning av kolsyra, med ett begränsande pH på ~5,7 (referens: Kendall, J. (1916), tidskrift för American Chemical Society 38 (11): 2460-2466).
renande vatten
renat vatten behövs för många industriella tillämpningar, liksom för konsumtion. Människor behöver vatten som inte innehåller för mycket salt eller andra föroreningar. Vanliga föroreningar inkluderar kemikalier eller skadliga bakterier. Vissa lösta ämnen är acceptabla och till och med önskvärda för upplevd smakförbättring. Vatten som är lämpligt för att dricka kallas dricksvatten.
sex populära metoder för rening av vatten är:
- filtrering: Vatten passerar genom en sikt som fångar små partiklar. Ju stramare siktens nät, desto mindre måste partiklarna passera igenom. Filtrering är inte tillräcklig för att helt rena vatten, men det är ofta ett nödvändigt första steg, eftersom sådana partiklar kan störa de mer grundliga reningsmetoderna.
- kokning: vatten värms upp till kokpunkten tillräckligt länge för att inaktivera eller döda mikroorganismer som normalt lever i vatten vid rumstemperatur. I områden där vattnet är ”hårt” (innehållande upplösta kalciumsalter) sönderdelas kokande bikarbonatjonen, vilket resulterar i att vissa (men inte alla) av det upplösta kalciumet fälls ut i form av kalciumkarbonat. Detta är den så kallade ”pälsen” som bygger upp på vattenkokare etc. i områden med hårt vatten. Med undantag för kalcium tar kokning inte bort lösta ämnen med högre kokpunkt än vatten och ökar faktiskt deras koncentration (på grund av att något vatten går förlorat som ånga)
- kolfiltrering: Kol, en form av kol med en hög yta på grund av dess beredningssätt, adsorberar många föreningar, inklusive vissa giftiga föreningar. Vatten passerar genom aktivt kol för att avlägsna sådana föroreningar. Denna metod används oftast i hushålls vattenfilter och fisktankar. Hushållsfilter för dricksvatten innehåller ibland också silver, spårmängder av silverjoner som har en bakteriedödande effekt.
- destillering: destillation innebär kokning av vattnet för att producera vattenånga. Vattenångan stiger sedan till en kyld yta där den kan kondensera tillbaka till en vätska och samlas upp. Eftersom de lösta ämnena normalt inte förångas förblir de i den kokande lösningen. Även destillation renar inte helt vatten, på grund av föroreningar med liknande kokpunkter och droppar av ofördunstad vätska som bärs med ångan. Emellertid kan 99,9% rent vatten erhållas genom destillation.
- omvänd osmos: mekaniskt tryck appliceras på en oren lösning för att tvinga rent vatten genom ett halvgenomsläppligt membran. Termen är omvänd osmos, eftersom normal osmos skulle leda till att rent vatten rör sig i andra riktningen för att späda föroreningarna. Omvänd osmos är teoretiskt den mest grundliga metoden för storskalig vattenrening tillgänglig, även om perfekta halvpermeabla membran är svåra att skapa. på utbyteskromatografi: i detta fall passerar vatten genom en laddad hartskolonn som har sidokedjor som fångar kalcium, magnesium och andra tungmetalljoner. I många laboratorier har denna reningsmetod ersatt destillation, eftersom den ger en hög volym mycket rent vatten snabbare och med mindre energianvändning än andra processer. Vattenrenat på detta sätt kallas avjoniserat vatten.
slösa vatten
slösa vatten är missbruk av vatten, dvs använda det i onödan. Ett exempel är användningen av vatten, särskilt vatten renat till mänskliga säkra dricksstandarder, i onödig bevattning. Även i hemmen kan vatten slösas bort om toaletten spolas i onödan eller tanken läcker. Att få vatten att bli förorenat kan vara det största enskilda missbruket av vatten. I den mån ett förorenande ämne begränsar annan användning av vattnet blir det slöseri med resursen, oavsett fördelar för förorenaren.
mytologi
vatten är ett av de fyra klassiska elementen tillsammans med eld, jord och luft och betraktades som ylem eller grundläggande saker i universum. Vatten ansågs kallt och fuktigt. I teorin om de fyra kroppsliga humörerna var vatten somassocierad med slem. Vatten var också ett av de fem elementen i kinesisk Taoism, tillsammans med jord, eld, trä och metall.
vattenrättigheter och utveckling
Unescos World Water Development Report (WWDR, 2003) från World Water Assessment Program visar att världen under de kommande 20 åren står inför en aldrig tidigare skådad brist på dricksvatten. Mängden vatten som är tillgängligt för alla förutspås minska med 30%. Orsakerna är förorening, global uppvärmning och politiska problem. Mer än 2,2 miljoner människor dog år 2000 av sjukdomar relaterade till konsumtion av förorenat vatten. År 2004 rapporterade den brittiska välgörenhetsorganisationen WaterAid att ett barn dör var 15: e sekund på grund av lätt förebyggbara vattenrelaterade sjukdomar.Rapporten indikerar stora globala skillnader i råvolymen av tillgängligt vatten: från 10 m3 per person och år i Kuwait till 812.121 m3 i Franska Guyana. Men rikare länder som Kuwait kan lättare hantera låg vattentillgänglighet. I USA är vattenlagen uppdelad mellan två juridiska doktriner: riparian vattenrättigheter, som används i de östra och södra staterna där det finns ett överflöd av vatten och anslagsdoktrinen (eller Colorado-doktrinen) som används i de torra västra staterna.