Allgemein
Der feste Zustand von Wasser ist als Eis bekannt; Der gasförmige Zustand ist als Wasserdampf (oder Dampf) bekannt. Die Einheiten der Temperatur (früher der Grad Celsius und jetzt der Kelvin) sind definiert als der Tripelpunkt von Wasser, 273,16 K (0,01 ° C) und 611,2 Pa, die Temperatur und der Druck, bei dem festes, flüssiges und gasförmiges Wasser im Gleichgewicht koexistieren. Wasser zeigt einige sehr seltsame Verhaltensweisen, einschließlich der Bildung von Zuständen wie glasartigem Eis, einem nichtkristallinen (glasigen) festen Zustand von Wasser.
Bei Temperaturen größer als 647 K und Drücken größer als 22,064 MPa nimmt eine Ansammlung von Wassermolekülen einen überkritischen Zustand an, in dem flüssigkeitsartige Cluster innerhalb einer dampfartigen Phase schwimmen.
Der Flüssigkeitswasserweg ist ein Maß für die Menge an flüssigem Wasser in einer Luftsäule.
Die dipolare Natur des Wassermoleküls
Ein wichtiges Merkmal des Wassermoleküls ist seine polare Natur. Das Wassermolekül bildet einen Winkel mit Wasserstoffatomen an den Spitzen und Sauerstoff am Scheitelpunkt. Da Sauerstoff eine höhere Elektronegativität als Wasserstoff hat, hat die Seite des Moleküls mit dem Sauerstoffatom eine teilweise negative Ladung. Ein Molekül mit einer solchen Ladungsdifferenz wird als Dipol bezeichnet. Die Ladungsunterschiede bewirken, dass Wassermoleküle voneinander angezogen werden (die relativ positiven Bereiche werden von den relativ negativen Bereichen angezogen) und von anderen polaren Molekülen. Diese Anziehungskraft wird als Wasserstoffbindung bezeichnet.
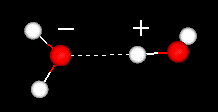 Wasserstoffbindung zwischen zwei Wassermolekülen
Wasserstoffbindung zwischen zwei Wassermolekülen
Diese relativ schwache (relativ zu den kovalenten Bindungen innerhalb des Wassermoleküls selbst) Anziehung führt zu physikalischen Eigenschaften wie einem relativ hohen Siedepunkt, da viel Wärmeenergie erforderlich ist, um die Wasserstoffbrückenbindungen zwischen Molekülen aufzubrechen. Zum Beispiel ist Schwefel das Element unter Sauerstoff im Periodensystem, und seine äquivalente Verbindung, Schwefelwasserstoff (H2S) hat keine Wasserstoffbrückenbindungen, und obwohl es das doppelte Molekulargewicht von Wasser hat, ist es ein Gas bei Raumtemperatur. Die zusätzliche Bindung zwischen Wassermolekülen verleiht flüssigem Wasser auch eine große spezifische Wärmekapazität.
Die Wasserstoffbindung verleiht Wassermolekülen auch beim Gefrieren ein ungewöhnliches Verhalten. Genau wie die meisten anderen Materialien wird die Flüssigkeit mit abnehmender Temperatur dichter. Im Gegensatz zu den meisten anderen Materialien bedeutet das Vorhandensein von Wasserstoffbrückenbindungen jedoch, dass die Moleküle, wenn sie sich neu anordnen, um ihre Energie zu minimieren, eine Struktur bilden, die tatsächlich eine geringere Dichte aufweist: Daher schwimmt die feste Form, Eis, in Wasser. Mit anderen Worten, Wasser dehnt sich beim Gefrieren aus (die meisten anderen Materialien schrumpfen beim Erstarren). Flüssiges Wasser erreicht seine höchste Dichte bei einer Temperatur von 4 ° C. Dies hat eine interessante Konsequenz für das Wasserleben im Winter. An der Oberfläche gekühltes Wasser wird dichter und sinkt, wodurch Konvektionsströme entstehen, die den gesamten Wasserkörper kühlen, aber wenn die Temperatur des Seewassers 4 ° C erreicht, wird das Wasser an der Oberfläche, wenn es weiter abkühlt, weniger dicht und bleibt als Oberflächenschicht, die schließlich Eis bildet. Da die Abwärtskonvektion von kälterem Wasser durch die Dichteänderung blockiert wird, hat jedes große Gewässer, das im Winter gefroren ist, den größten Teil seines Wassers noch flüssig bei 4 ° C unter der eisigen Oberfläche, so dass Fische überleben können. Dies ist eines der wichtigsten Beispiele für fein abgestimmte physikalische Eigenschaften, die das Leben auf der Erde unterstützen und als Argument für das anthropische Prinzip verwendet werden.
Eine weitere Folge ist, dass Eis schmilzt, wenn genügend Druck ausgeübt wird.
Struktur von Wasser und Eis
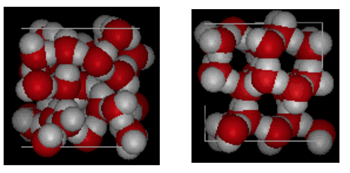
Oben gezeigt ist ein nebeneinander Vergleich einer Box 10 Angström über. Es zeigt deutlich, dass Eis aufgrund der Wasserstoffbindung, die auftritt, wenn sich der Zustand von flüssig zu fest ändert, mehr Platz einnimmt. In Eis Ih bildet jedes Wasser vier Wasserstoffbrückenbindungen mit O—O-Abständen von 2,76 Angström zum nächsten Sauerstoffnachbarn. Aufgrund der geordneten Struktur im Eis gibt es weniger H20-Moleküle in einem bestimmten Volumenraum.
Wasser als Lösungsmittel
Wasser ist aufgrund seiner Polarität auch ein gutes Lösungsmittel. Die Lösungsmitteleigenschaften von Wasser sind in der Biologie von entscheidender Bedeutung, da viele biochemische Reaktionen nur in wässrigen Lösungen stattfinden (z. B. Reaktionen im Zytoplasma und im Blut). Darüber hinaus wird Wasser zum Transport biologischer Moleküle verwendet.
Wenn eine ionische oder polare Verbindung in Wasser eintritt, ist sie von Wassermolekülen umgeben. Die verhältnismäßig kleine Größe von Wassermolekülen lässt gewöhnlich viele Wassermoleküle ein Molekül des aufgelösten Stoffes umgeben. Die teilweise negativen Dipole des Wassers werden von positiv geladenen Komponenten des gelösten Stoffes angezogen und umgekehrt von den positiven Dipolen.
Im Allgemeinen sind ionische und polare Substanzen wie Säuren, Alkohole und Salze in Wasser leicht löslich, unpolare Substanzen wie Fette und Öle nicht. Unpolare Moleküle bleiben in Wasser zusammen, weil es für die Wassermoleküle energetisch günstiger ist, sich miteinander zu verbinden, als van-der-Waals-Wechselwirkungen mit unpolaren Molekülen einzugehen.
Ein Beispiel für einen ionischen gelösten Stoff ist Speisesalz; Das Natriumchlorid, NaCl, trennt sich in Na + -Kationen und Cl-Anionen, die jeweils von Wassermolekülen umgeben sind. Die Ionen werden dann leicht von ihrem Kristallgitter in Lösung transportiert. Ein Beispiel für einen nichtionischen gelösten Stoff ist Haushaltszucker. Die Wasserdipole binden Wasserstoff an die dipolaren Bereiche des Zuckermoleküls und lassen es in Lösung abtransportieren.
Kohäsion und Oberflächenspannung
Die starken Wasserstoffbrückenbindungen verleihen Wasser eine hohe Kohäsion und damit Oberflächenspannung. Dies zeigt sich, wenn kleine Mengen Wasser auf eine unlösliche Oberfläche gegeben werden und das Wasser als Tropfen zusammenbleibt. Diese Eigenschaft ist wichtig, wenn Wasser durch Xylem herauf Stämme in den Anlagen getragen wird; die starken intermolekularen Anziehungskräfte halten die Wassersäule zusammen und verhindern die Spannung, die durch Transpirationszug verursacht wird. Andere Flüssigkeiten mit geringerer Oberflächenspannung hätten eine höhere Tendenz zum „Reißen“, wodurch Vakuum- oder Lufteinschlüsse gebildet würden und das Xylemgefäß funktionsunfähig würde.
Leitfähigkeit
Reines Wasser ist eigentlich ein guter Isolator (schlechter Leiter), was bedeutet, dass es Elektrizität nicht gut leitet. Da Wasser jedoch ein so gutes Lösungsmittel ist, ist oft ein gelöster Stoff darin gelöst, am häufigsten Salz. Wenn Wasser solche Verunreinigungen aufweist, kann es Elektrizität viel besser leiten, da Verunreinigungen wie Salz freie Ionen in wässriger Lösung enthalten, durch die ein elektrischer Strom fließen kann.
Elektrolyse
Wasser kann durch Durchleiten eines Stroms in seine Bestandteile Wasserstoff und Sauerstoff gespalten werden. Dieser Prozess wird Elektrolyse genannt. Wassermoleküle lösen sich auf natürliche Weise in H + – und OH- Ionen auf, die zur Kathode bzw. zur Anode gezogen werden. An der Kathode nehmen zwei H + -Ionen Elektronen auf und bilden H2-Gas. An der Anode verbinden sich vier OH-Ionen und setzen O2-Gas, molekulares Wasser und vier Elektronen frei. Die erzeugten Gase blasen an die Oberfläche, wo sie gesammelt werden können.
Reaktivität
Chemisch gesehen ist Wasser amphoter: es kann als Säure oder Base wirken. Gelegentlich wird der Begriff Hydroxylsäure verwendet, wenn Wasser als Säure in einer chemischen Reaktion wirkt. Bei einem pH-Wert von 7 (neutral) ist die Konzentration der Hydroxidionen (OH-) gleich der der Hydronium (H3O +) – oder Wasserstoffionen (H+) -Ionen. Wenn das Gleichgewicht gestört ist, wird die Lösung sauer (höhere Konzentration an Hydroniumionen) oder basisch (höhere Konzentration an Hydroxidionen).
Wasser kann in Reaktionen entweder als Säure oder als Base wirken. Nach dem Brønsted-Lowry-System ist eine Säure definiert als eine Spezies, die ein Proton (ein H + -Ion) in einer Reaktion spendet, und eine Base als eine, die ein Proton empfängt. Bei der Reaktion mit einer stärkeren Säure wirkt Wasser als Base, bei der Reaktion mit einer schwächeren Säure als Säure. Zum Beispiel empfängt es ein H + -Ion von HCl im Gleichgewicht:
HCl + H2O —> H3O+ + Cl-
Hier wirkt Wasser als Base, indem es ein H + -Ion aufnimmt. Eine Säure spendet ein H + -Ion, und Wasser kann dies auch tun, wie bei der Reaktion mit Ammoniak, NH3:
NH3 + H2O —> NH4+ + OH-
pH in der Praxis
Theoretisch hat reines Wasser einen pH-Wert von 7. In der Praxis ist reines Wasser sehr schwierig herzustellen. Wasser, das für längere Zeit der Luft ausgesetzt wird, löst Kohlendioxid schnell auf und bildet eine Lösung von Kohlensäure mit einem Grenzph-Wert von ~ 5,7 (Referenz: Kendall, J. (1916), Zeitschrift der American Chemical Society 38 (11): 2460-2466).
Reinigendes Wasser
Gereinigtes Wasser wird für viele industrielle Anwendungen sowie für den Verbrauch benötigt. Der Mensch benötigt Wasser, das nicht zu viel Salz oder andere Verunreinigungen enthält. Häufige Verunreinigungen sind Chemikalien oder schädliche Bakterien. Einige gelöste Stoffe sind akzeptabel und sogar wünschenswert für die wahrgenommene Geschmacksverstärkung. Wasser, das zum Trinken geeignet ist, wird als Trinkwasser bezeichnet.
Sechs beliebte Methoden zur Reinigung von Wasser sind:
- Filtern: Wasser wird durch ein Sieb geleitet, das kleine Partikel auffängt. Je enger das Siebgewebe ist, desto kleiner müssen die Partikel sein, um hindurchtreten zu können. Die Filterung reicht nicht aus, um Wasser vollständig zu reinigen, ist jedoch häufig ein notwendiger erster Schritt, da solche Partikel die gründlicheren Reinigungsmethoden beeinträchtigen können.
- Kochen: Wasser wird lange genug auf seinen Siedepunkt erhitzt, um Mikroorganismen, die normalerweise in Wasser bei Raumtemperatur leben, zu inaktivieren oder abzutöten. In Bereichen, in denen das Wasser „hart“ ist (mit gelösten Calciumsalzen), zersetzt das Kochen das Bicarbonat-Ion, was dazu führt, dass einige (aber nicht alle) des gelösten Calciums in Form von Calciumcarbonat ausgefällt werden. Dies ist das sogenannte „Fell“, das sich auf Kesselelementen usw. aufbaut. in Gebieten mit hartem Wasser. Mit Ausnahme von Calcium entfernt das Kochen keine gelösten Stoffe mit höherem Siedepunkt als Wasser und erhöht tatsächlich ihre Konzentration (da etwas Wasser als Dampf verloren geht)
- Kohlenstofffilterung: Holzkohle, eine Form von Kohlenstoff mit einer hohen Oberfläche aufgrund seiner Art der Herstellung, adsorbiert viele Verbindungen, einschließlich einiger toxischer Verbindungen. Wasser wird durch Aktivkohle geleitet, um solche Verunreinigungen zu entfernen. Diese Methode wird am häufigsten in Haushaltswasserfiltern und Aquarien verwendet. Haushaltsfilter für Trinkwasser enthalten manchmal auch Silber, Spuren von Silberionen wirken bakterizid.
- Destillieren: Bei der Destillation wird das Wasser gekocht, um Wasserdampf zu erzeugen. Der Wasserdampf steigt dann auf eine gekühlte Oberfläche, wo er wieder zu einer Flüssigkeit kondensieren und gesammelt werden kann. Da die gelösten Stoffe normalerweise nicht verdampft werden, verbleiben sie in der siedenden Lösung. Selbst die Destillation reinigt das Wasser nicht vollständig, da Verunreinigungen mit ähnlichen Siedepunkten und Tröpfchen nicht verdampfter Flüssigkeit mit dem Dampf mitgeführt werden. Durch Destillation kann jedoch 99,9% reines Wasser erhalten werden.
- Umkehrosmose: Mechanischer Druck wird auf eine unreine Lösung ausgeübt, um reines Wasser durch eine semipermeable Membran zu drücken. Der Begriff ist Umkehrosmose, weil normale Osmose dazu führen würde, dass sich reines Wasser in die andere Richtung bewegt, um die Verunreinigungen zu verdünnen. Die Umkehrosmose ist theoretisch die gründlichste Methode zur Wasserreinigung in großem Maßstab, obwohl perfekte semipermable Membranen schwer zu erstellen sind. bei der Austauschchromatographie: In diesem Fall wird Wasser durch eine geladene Harzsäule geleitet, die Seitenketten aufweist, die Calcium-, Magnesium- und andere Schwermetallionen einfangen. In vielen Labors hat diese Reinigungsmethode die Destillation ersetzt, da sie ein hohes Volumen an sehr reinem Wasser schneller und mit weniger Energieverbrauch liefert als andere Prozesse. Auf diese Weise gereinigtes Wasser wird als entionisiertes Wasser bezeichnet.
Wasserverschwendung
Wasserverschwendung ist der Missbrauch von Wasser, d.h. unnötiger Gebrauch. Ein Beispiel ist die Verwendung von Wasser, insbesondere von Wasser, das nach menschlichem Trinkwasserstandard gereinigt wurde, bei der Bewässerung. In Privathaushalten kann Wasser verschwendet werden, wenn die Toilette unnötig gespült wird oder der Tank undicht ist. Die Verschmutzung von Wasser kann der größte einzelne Missbrauch von Wasser sein. In dem Maße, in dem ein Schadstoff die andere Nutzung des Wassers einschränkt, wird es zu einer Verschwendung der Ressource, unabhängig vom Nutzen für den Verursacher.
Mythologie
Wasser ist neben Feuer, Erde und Luft eines der vier klassischen Elemente und wurde als Ylem oder Grundstoff des Universums angesehen. Wasser galt als kalt und feucht. In der Theorie der vier Körpersäfte wurde Wasser mit Schleim assoziiert. Wasser war auch eines der fünf Elemente im chinesischen Taoismus, zusammen mit Erde, Feuer, Holz und Metall.
Wasserrechte und Entwicklung
Der World Water Development Report (WWDR, 2003) der UNESCO aus dem World Water Assessment Program zeigt, dass die Welt in den nächsten 20 Jahren mit einem beispiellosen Mangel an Trinkwasser konfrontiert ist. Die Menge an Wasser, die jedem zur Verfügung steht, wird voraussichtlich um 30% sinken. Die Ursachen sind Kontamination, globale Erwärmung und politische Probleme. Mehr als 2,2 Millionen Menschen starben im Jahr 2000 an Krankheiten im Zusammenhang mit dem Konsum von kontaminiertem Wasser. Im Jahr 2004 berichtete die britische Wohltätigkeitsorganisation WaterAid, dass alle 15 Sekunden ein Kind an leicht vermeidbaren wasserbedingten Krankheiten stirbt.Der Bericht weist auf große globale Unterschiede in der Rohwassermenge hin: von 10 m3 pro Person und Jahr in Kuwait bis 812.121 m3 in Französisch-Guayana. Reichere Länder wie Kuwait können jedoch leichter mit einer geringen Wasserverfügbarkeit umgehen. In den Vereinigten Staaten ist das Wasserrecht in zwei Rechtslehren unterteilt: Uferwasserrechte, die in den östlichen und südlichen Staaten verwendet werden, in denen es reichlich Wasser gibt, und die Aneignungsdoktrin (oder Colorado-Doktrin), die in den trockenen westlichen Staaten verwendet wird.