Generale
Lo stato solido dell’acqua è noto come ghiaccio; lo stato gassoso è noto come vapore acqueo (o vapore). Le unità di temperatura (precedentemente il grado Celsius e ora il Kelvin) sono definite in termini di punto triplo dell’acqua, 273,16 K (0,01 °C) e 611,2 Pa, la temperatura e la pressione alla quale l’acqua solida, liquida e gassosa coesistono in equilibrio. L’acqua presenta alcuni comportamenti molto strani, tra cui la formazione di stati come il ghiaccio vetroso, uno stato solido dell’acqua non cristallino (vetroso).
A temperature superiori a 647 K e pressioni superiori a 22,064 MPa, una raccolta di molecole d’acqua assume una condizione supercritica, in cui i cluster simili a liquidi galleggiano all’interno di una fase simile al vapore.
Il percorso dell’acqua liquida è una misura della quantità di acqua liquida in una colonna d’aria.
La natura dipolare della molecola d’acqua
Una caratteristica importante della molecola d’acqua è la sua natura polare. La molecola d’acqua forma un angolo, con atomi di idrogeno alle punte e ossigeno al vertice. Poiché l’ossigeno ha un’elettronegatività superiore all’idrogeno, il lato della molecola con l’atomo di ossigeno ha una carica negativa parziale. Una molecola con una tale differenza di carica è chiamata dipolo. Le differenze di carica fanno sì che le molecole d’acqua siano attratte l’una dall’altra (le aree relativamente positive sono attratte dalle aree relativamente negative) e da altre molecole polari. Questa attrazione è conosciuta come legame idrogeno.
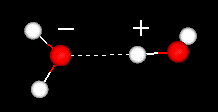 legame idrogeno tra due molecole d’acqua
legame idrogeno tra due molecole d’acqua
Questa attrazione relativamente debole (rispetto ai legami covalenti all’interno della molecola d’acqua stessa) si traduce in proprietà fisiche come un punto di ebollizione relativamente alto, perché è necessaria molta energia termica per rompere i legami idrogeno tra le molecole. Ad esempio, lo zolfo è l’elemento sotto l’ossigeno nella tavola periodica e il suo composto equivalente, l’idrogeno solforato (H2S) non ha legami idrogeno e, sebbene abbia il doppio del peso molecolare dell’acqua, è un gas a temperatura ambiente. Il legame extra tra le molecole d’acqua conferisce anche all’acqua liquida una grande capacità termica specifica.
Il legame con idrogeno conferisce alle molecole d’acqua un comportamento insolito durante il congelamento. Proprio come la maggior parte degli altri materiali, il liquido diventa più denso con l’abbassamento della temperatura. Tuttavia, a differenza della maggior parte degli altri materiali, quando raffreddati al punto di congelamento vicino, la presenza di legami idrogeno significa che le molecole, mentre si riorganizzano per ridurre al minimo la loro energia, formano una struttura che è in realtà di densità inferiore: quindi la forma solida, ghiaccio, galleggerà in acqua. In altre parole, l’acqua si espande mentre si congela (la maggior parte degli altri materiali si restringe alla solidificazione). L’acqua liquida raggiunge la sua massima densità ad una temperatura di 4 °C. Ciò ha una conseguenza interessante per la vita dell’acqua in inverno. L’acqua raffreddata in superficie diventa più densa e affonda, formando correnti di convezione che raffreddano l’intero corpo idrico, ma quando la temperatura dell’acqua del lago raggiunge i 4°C, l’acqua sulla superficie, mentre si raffredda ulteriormente, diventa meno densa e rimane come uno strato superficiale che alla fine forma ghiaccio. Poiché la convezione verso il basso dell’acqua più fredda è bloccata dal cambiamento di densità, qualsiasi grande corpo d’acqua congelato in inverno avrà la maggior parte della sua acqua ancora liquida a 4°C sotto la superficie ghiacciata, permettendo ai pesci di sopravvivere. Questo è uno dei principali esempi di proprietà fisiche finemente sintonizzate che supportano la vita sulla Terra che viene usato come argomento per il principio antropico.
Un’altra conseguenza è che il ghiaccio si scioglierà se viene applicata una pressione sufficiente.
Struttura di acqua e ghiaccio
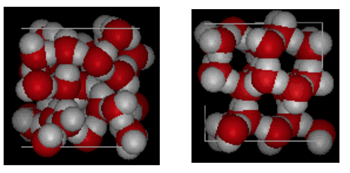
Mostrato sopra è un confronto fianco a fianco di una scatola 10 Angstroms attraverso. Mostra chiaramente che il ghiaccio occupa più spazio a causa del legame di idrogeno che si verifica quando lo stato cambia da liquido a solido. In ice Ih, ogni acqua forma quattro legami idrogeno con O – – – O distanze di 2,76 Angstrom al vicino di ossigeno più vicino. A causa della struttura ordinata nel ghiaccio ci sono meno molecole H20 in un dato spazio di volume.
Acqua come solvente
L’acqua è anche un buon solvente grazie alla sua polarità. Le proprietà solventi dell’acqua sono vitali in biologia, perché molte reazioni biochimiche avvengono solo all’interno di soluzioni acquose (ad esempio, reazioni nel citoplasma e nel sangue). Inoltre, l’acqua viene utilizzata per trasportare molecole biologiche.
Quando un composto ionico o polare entra nell’acqua, è circondato da molecole d’acqua. La dimensione relativamente piccola delle molecole d’acqua consente in genere a molte molecole d’acqua di circondare una molecola di soluto. I dipoli parzialmente negativi dell’acqua sono attratti da componenti caricati positivamente del soluto e viceversa per i dipoli positivi.
In generale, le sostanze ioniche e polari come acidi, alcoli e sali sono facilmente solubili in acqua e le sostanze non polari come grassi e oli non lo sono. Molecole non polari stare insieme in acqua perché è energeticamente più favorevole per le molecole d’acqua a legame idrogeno tra loro che impegnarsi in interazioni di van der Waals con molecole non polari.
Un esempio di soluto ionico è il sale da cucina; il cloruro di sodio, NaCl, si separa in cationi Na+ e anioni Cl, ciascuno circondato da molecole d’acqua. Gli ioni vengono quindi facilmente trasportati lontano dal loro reticolo cristallino in soluzione. Un esempio di soluto non ionico è lo zucchero da tavola. I dipoli d’acqua legame idrogeno alle regioni dipolari della molecola di zucchero e permettono di essere portato via in soluzione.
Coesione e tensione superficiale
I forti legami idrogeno conferiscono all’acqua un’elevata coesione e, di conseguenza, tensione superficiale. Ciò è evidente quando piccole quantità di acqua vengono messe su una superficie non solubile e l’acqua rimane insieme come gocce. Questa caratteristica è importante quando l’acqua viene trasportata attraverso gli steli di xilema nelle piante; le forti attrazioni intermolecolari tengono insieme la colonna d’acqua e prevengono la tensione causata dalla trazione della traspirazione. Altri liquidi con minore tensione superficiale avrebbero una maggiore tendenza a” strappare”, formando vuoto o sacche d’aria e rendendo il recipiente dello xilema inoperativo.
Conducibilità
L’acqua pura è in realtà un buon isolante (povero conduttore), il che significa che non conduce bene l’elettricità. Poiché l’acqua è un buon solvente, tuttavia, spesso ha un soluto sciolto in esso, il più delle volte sale. Se l’acqua ha tali impurità, allora può condurre l’elettricità molto meglio, perché impurità come il sale comprendono ioni liberi in soluzione acquosa con cui una corrente elettrica può fluire.
Elettrolisi
L’acqua può essere divisa nei suoi elementi costitutivi, idrogeno e ossigeno, facendo passare una corrente attraverso di essa. Questo processo è chiamato elettrolisi. Le molecole d’acqua si dissociano naturalmente in ioni H+ e OH, che vengono tirati verso il catodo e l’anodo, rispettivamente. Al catodo, due ioni H + raccolgono elettroni e formano gas H2. All’anodo, quattro ioni OH si combinano e rilasciano gas O2, acqua molecolare e quattro elettroni. I gas prodotti bolla in superficie, dove possono essere raccolti.
Reattività
Chimicamente, l’acqua è anfotera: in grado di agire come acido o base. Occasionalmente il termine acido idrossico viene utilizzato quando l’acqua agisce come un acido in una reazione chimica. A un pH di 7 (neutro), la concentrazione di ioni idrossido (OH-) è uguale a quella degli ioni idronio (H3O+) o ioni idrogeno (H+). Se l’equilibrio è disturbato, la soluzione diventa acida (maggiore concentrazione di ioni idronio) o basica (maggiore concentrazione di ioni idrossido).
L’acqua può agire come un acido o una base nelle reazioni. Secondo il sistema di Brønsted-Lowry, un acido è definito come una specie che dona un protone (uno ion H+) in una reazione e una base come una che riceve un protone. Quando reagisce con un acido più forte, l’acqua agisce come una base; quando reagisce con un acido più debole, agisce come un acido. Ad esempio, riceve uno ion H+ da HCl nell’equilibrio:
HCl + H2O- – – > H3O+ + Cl –
Qui l’acqua agisce come base, ricevendo uno H H+. Un acido dona uno ion H + e l’acqua può anche farlo, come nella reazione con ammoniaca, NH3:
NH3 + H2O- – – > NH4+ + OH-
pH in pratica
In teoria, l’acqua pura ha un pH di 7. In pratica, l’acqua pura è molto difficile da produrre. L’acqua lasciata esposta all’aria per qualsiasi periodo di tempo dissolverà rapidamente l’anidride carbonica, formando una soluzione di acido carbonico, con un pH limitante di ~5,7 (riferimento: Kendall, J. (1916), Journal of the American Chemical Society 38 (11): 2460-2466).
Acqua purificante
L’acqua purificata è necessaria per molte applicazioni industriali e per il consumo. Gli esseri umani richiedono acqua che non contenga troppo sale o altre impurità. Le impurità comuni includono sostanze chimiche o batteri nocivi. Alcuni soluti sono accettabili e persino desiderabili per il miglioramento del gusto percepito. L’acqua che è adatta per bere è definita acqua potabile.
Sei metodi popolari per purificare l’acqua sono:
- Filtraggio: L’acqua viene passata attraverso un setaccio che cattura piccole particelle. Più stretta è la maglia del setaccio, più piccole devono essere le particelle da attraversare. Il filtraggio non è sufficiente per purificare completamente l’acqua, ma è spesso un primo passo necessario, poiché tali particelle possono interferire con i metodi di purificazione più approfonditi.
- Ebollizione: l’acqua viene riscaldata al suo punto di ebollizione abbastanza a lungo da inattivare o uccidere i microrganismi che normalmente vivono in acqua a temperatura ambiente. Nelle aree in cui l’acqua è “dura”, (contenente sali di calcio disciolti), l’ebollizione decompone lo bic bicarbonato, causando la precipitazione di alcuni (ma non tutti) del calcio disciolto sotto forma di carbonato di calcio. Questa è la cosiddetta “pelliccia”che si accumula sugli elementi del bollitore ecc. in aree di acqua dura. Ad eccezione del calcio, l’ebollizione non rimuove i soluti con un punto di ebollizione superiore all’acqua e anzi ne aumenta la concentrazione (a causa della perdita di acqua sotto forma di vapore)
- Filtraggio del carbonio: Il carbone di legna, una forma di carbonio con un’elevata superficie a causa della sua modalità di preparazione, assorbe molti composti, tra cui alcuni composti tossici. L’acqua viene fatta passare attraverso il carbone attivo per rimuovere tali contaminanti. Questo metodo è più comunemente usato nei filtri per l’acqua domestica e negli acquari. I filtri domestici per l’acqua potabile a volte contengono anche argento, tracce di ioni d’argento che hanno un effetto battericida.
- Distillazione: La distillazione consiste nel far bollire l’acqua per produrre vapore acqueo. Il vapore acqueo sale quindi ad una superficie raffreddata dove può condensare nuovamente in un liquido ed essere raccolto. Poiché i soluti non sono normalmente vaporizzati, rimangono nella soluzione bollente. Anche la distillazione non purifica completamente l’acqua, a causa di contaminanti con punti di ebollizione simili e goccioline di liquido non vaporizzato trasportate con il vapore. Tuttavia, il 99,9% di acqua pura può essere ottenuto per distillazione.
- Osmosi inversa: La pressione meccanica è applicata ad una soluzione impura per forzare l’acqua pura attraverso una membrana semipermeabile. Il termine è osmosi inversa, perché l’osmosi normale si tradurrebbe in acqua pura che si muove nell’altra direzione per diluire le impurità. L’osmosi inversa è teoricamente il metodo più completo di purificazione dell’acqua su larga scala disponibile, anche se le membrane semi-permabili perfette sono difficili da creare. cromatografia a scambio: in questo caso, l’acqua viene fatta passare attraverso una colonna di resina carica che ha catene laterali che intrappolano calcio, magnesio e altri ioni di metalli pesanti. In molti laboratori, questo metodo di purificazione ha sostituito la distillazione, in quanto fornisce un elevato volume di acqua molto pura più rapidamente e con un minor consumo di energia rispetto ad altri processi. L’acqua purificata in questo modo è chiamata acqua deionizzata.
Sprecare acqua
Sprecare acqua è l’abuso di acqua, cioè usarla inutilmente. Un esempio è l’uso di acqua, in particolare acqua purificata secondo gli standard umani di bere sicuro, in irrigazione non necessaria. Inoltre, nelle case, l’acqua può essere sprecata se la toilette viene lavata inutilmente o il serbatoio perde. Causare l’acqua a diventare inquinata può essere il più grande singolo abuso di acqua. Nella misura in cui un inquinante limita altri usi dell’acqua, diventa uno spreco della risorsa, indipendentemente dai benefici per l’inquinatore.
Mitologia
L’acqua è uno dei quattro elementi classici insieme al fuoco, alla terra e all’aria, ed è stata considerata come l’ylem, o roba di base dell’universo. L’acqua era considerata fredda e umida. Nella teoria dei quattro umori corporei, l’acqua era asssociata alla flemma. L’acqua era anche uno dei cinque elementi del taoismo cinese, insieme alla terra, al fuoco, al legno e al metallo.
Diritti e sviluppo dell’acqua
Il World Water Development Report dell’UNESCO (WWDR, 2003) dal suo World Water Assessment Program indica che nei prossimi 20 anni il mondo sta affrontando una mancanza senza precedenti di acqua potabile. Si prevede che la quantità di acqua disponibile per tutti diminuirà del 30%. Le cause sono la contaminazione, il riscaldamento globale e problemi politici. Più di 2,2 milioni di persone sono morte nel 2000 a causa di malattie legate al consumo di acqua contaminata. Nel 2004, l’ente di beneficenza britannico WaterAid ha riferito che un bambino muore ogni 15 secondi a causa di malattie facilmente prevenibili legate all’acqua.Il rapporto indica grandi disparità globali nel volume grezzo di acqua disponibile: da 10 m3 per persona all’anno in Kuwait a 812.121 m3 nella Guiana francese. Tuttavia, i paesi più ricchi come il Kuwait possono più facilmente far fronte alla bassa disponibilità di acqua. Negli Stati Uniti la legge sull’acqua è divisa tra due dottrine giuridiche: diritti idrici ripariali, utilizzati negli stati orientali e meridionali dove c’è abbondanza di acqua e la dottrina dell’appropriazione (o dottrina del Colorado) utilizzata negli stati occidentali aridi.