Algemeen
de vaste toestand van water wordt ijs genoemd; de gasvormige toestand wordt waterdamp (of stoom) genoemd. De eenheden van temperatuur (voorheen de graad Celsius en nu de Kelvin) worden gedefinieerd in termen van het drievoudige punt van water, 273,16 K (0,01 °C) en 611,2 Pa, de temperatuur en druk waarbij vast, vloeibaar en gasvormig water naast elkaar bestaan in evenwicht. Water vertoont een aantal zeer vreemd gedrag, met inbegrip van de vorming van staten zoals glasachtig ijs, een niet-kristallijne (glazig), vaste toestand van water.
bij temperaturen hoger dan 647 K en druk hoger dan 22,064 MPa neemt een verzameling watermoleculen een superkritische toestand aan, waarin vloeibare clusters zweven binnen een dampachtige fase.
het vloeistofwaterpad is een maat voor de hoeveelheid vloeibaar water in een luchtkolom.
het dipolaire karakter van het watermolecuul
een belangrijk kenmerk van het watermolecuul is zijn polaire aard. Het watermolecuul vormt een hoek, met waterstofatomen aan de uiteinden en zuurstof aan de top. Aangezien zuurstof een hogere elektronegativiteit heeft dan waterstof, heeft de zijde van het molecuul met het zuurstofatoom een gedeeltelijke negatieve lading. Een molecuul met zo ‘ n lastverschil wordt een dipool genoemd. De ladingsverschillen zorgen ervoor dat watermoleculen tot elkaar aangetrokken worden (de relatief positieve gebieden worden aangetrokken tot de relatief negatieve gebieden) en tot andere polaire moleculen. Deze attractie staat bekend als waterstofbindingen.
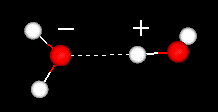 waterstofbinding tussen twee watermoleculen
waterstofbinding tussen twee watermoleculen
deze relatief zwakke aantrekking (ten opzichte van de covalente bindingen in het watermolecuul zelf) resulteert in fysische eigenschappen zoals een relatief hoog kookpunt, omdat veel warmte-energie nodig is om de waterstofbindingen tussen moleculen te breken. Zwavel is bijvoorbeeld het element onder zuurstof in het periodiek systeem, en de equivalente verbinding, waterstofsulfide (H2S) heeft geen waterstofbindingen, en hoewel het twee keer het molecuulgewicht van water heeft, is het een gas bij kamertemperatuur. De extra hechting tussen watermoleculen geeft ook vloeibaar water een grote specifieke warmtecapaciteit.Waterstofbinding geeft ook een ongewoon gedrag aan watermoleculen bij het invriezen. Net als de meeste andere materialen, wordt de vloeistof dichter bij het verlagen van de temperatuur. Echter, in tegenstelling tot de meeste andere materialen, wanneer afgekoeld tot nabij het vriespunt, de aanwezigheid van waterstofbindingen betekent dat de moleculen, als ze herschikken om hun energie te minimaliseren, vormen een structuur die eigenlijk van lagere dichtheid: vandaar de vaste vorm, ijs, zal drijven in water. Met andere woorden, water breidt uit als het bevriest (de meeste andere materialen krimpen bij stolling). Vloeibaar water bereikt zijn hoogste dichtheid bij een temperatuur van 4 °C. Dit heeft een interessant gevolg voor het waterleven in de winter. Water dat aan het oppervlak wordt gekoeld, wordt dichter en zinkt, waardoor convectiestromen ontstaan die het hele waterlichaam koelen, maar wanneer de temperatuur van het meerwater 4°C bereikt, wordt het water aan het oppervlak, naarmate het verder rilt, minder dicht en blijft het als een oppervlaktelaag die uiteindelijk ijs vormt. Aangezien de neerwaartse convectie van kouder water wordt geblokkeerd door de dichtheidsverandering, zal elk groot waterlichaam dat in de winter bevroren is, het grootste deel van zijn water nog vloeibaar hebben bij 4°C onder het ijzige oppervlak, waardoor vissen kunnen overleven. Dit is een van de belangrijkste voorbeelden van fijn afgestemde fysische eigenschappen die het leven op aarde ondersteunen dat wordt gebruikt als argument voor het antropische principe.
een ander gevolg is dat ijs zal smelten als er voldoende druk wordt uitgeoefend.
structuur van Water en ijs
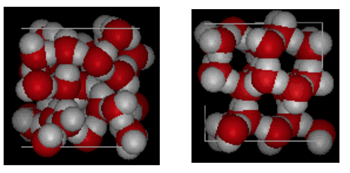
hierboven is een zij aan zij vergelijking van een doos 10 Angstroms over. Het laat duidelijk zien dat ijs meer ruimte inneemt vanwege de waterstofbinding die optreedt wanneer de toestand verandert van vloeibaar naar vast. In ijs Ih vormt elk water vier waterstofbindingen met o – – – o-afstanden van 2,76 Angstroms tot de dichtstbijzijnde zuurstofbuur. Vanwege de geordende structuur in ijs zijn er minder H20 moleculen in een bepaalde ruimte van volume.
Water als oplosmiddel
Water is ook een goed oplosmiddel vanwege zijn polariteit. De oplosmiddeleigenschappen van water zijn van vitaal belang in de biologie, omdat veel biochemische reacties alleen plaatsvinden binnen waterige oplossingen (bijvoorbeeld reacties in het cytoplasma en bloed). Daarnaast wordt water gebruikt om biologische moleculen te transporteren.
wanneer een ionische of polaire verbinding in water terechtkomt, wordt deze omgeven door watermoleculen. De relatief kleine grootte van watermoleculen staat typisch vele watermoleculen toe om één molecuul van opgeloste stof te omringen. De gedeeltelijk negatieve dipolen van het water worden aangetrokken door positief geladen componenten van de opgeloste stof, en vice versa voor de positieve dipolen.
in het algemeen zijn ionische en polaire stoffen zoals zuren, alcoholen en zouten gemakkelijk oplosbaar in water, en niet-polaire stoffen zoals vetten en oliën niet. Niet-polaire moleculen blijven bij elkaar in water omdat het energetisch gunstiger is voor de watermoleculen om waterstof aan elkaar te binden dan om deel te nemen aan Van der Waals interacties met niet-polaire moleculen.
een voorbeeld van een ionische opgeloste stof is keukenzout; het natriumchloride, NaCl, scheidt zich af in Na+ kationen en Cl – anionen, elk omgeven door watermoleculen. De ionen worden dan gemakkelijk van hun kristallijne rooster naar oplossing getransporteerd. Een voorbeeld van een nietionische opgeloste stof is tafelsuiker. De waterdipolen verbinden de waterstof aan de dipolaire gebieden van de suikermolecule en laten het weg in oplossing worden gedragen.
samenhang en oppervlaktespanning
de sterke waterstofbindingen geven water een hoge samenhang en, bijgevolg, oppervlaktespanning. Dit is duidelijk wanneer kleine hoeveelheden water op een niet oplosbaar oppervlak worden gebracht en het water als druppels bij elkaar blijft. Deze eigenschap is belangrijk wanneer water door xylem omhoog stengels in planten wordt gedragen; de sterke intermoleculaire attracties houden de waterkolom samen, en voorkomen spanning veroorzaakt door transpiratie trekken. Andere vloeistoffen met een lagere oppervlaktespanning zouden een hogere neiging tot “scheuren” hebben, waardoor vacuüm-of luchtzakken ontstaan en het Xylem-vat buiten werking wordt gesteld.
geleidbaarheid
zuiver water is eigenlijk een goede isolator( slechte geleider), wat betekent dat het elektriciteit niet goed geleidt. Omdat water zo ‘ n goed oplosmiddel is, heeft het echter vaak wat opgeloste stof, meestal zout. Als water dergelijke onzuiverheden heeft, kan het elektriciteit veel beter geleiden, omdat onzuiverheden zoals zout vrije ionen in waterige oplossing bevatten waardoor een elektrische stroom kan stromen.
elektrolyse
Water kan worden gesplitst in de samenstellende elementen, waterstof en zuurstof, door er een stroom doorheen te voeren. Dit proces heet elektrolyse. Watermoleculen distantiëren zich op natuurlijke wijze in H+ en OH – ionen, die respectievelijk naar de kathode en anode worden getrokken. Aan de kathode nemen twee H+ – ionen elektronen op en vormen H2-gas. Bij de anode combineren vier OH – ionen O2-gas, moleculair water en vier elektronen. De gassen geproduceerd bel naar de oppervlakte, waar ze kunnen worden verzameld.
reactiviteit
chemisch is water amfoterisch: kan werken als zuur of base. Soms wordt de term hydroxinezuur gebruikt wanneer water als zuur in een chemische reactie werkt. Bij een pH van 7 (neutraal) is de concentratie van hydroxideionen (OH -) gelijk aan die van hydronium (H3O+) of waterstofionen (h+). Als het evenwicht verstoord wordt, wordt de oplossing zuur (hogere concentratie hydroniumionen) of basisch (hogere concentratie hydroxideionen).
Water kan in reacties werken als zuur of als base. Volgens het Brønsted-Lowry-systeem wordt een zuur gedefinieerd als een soort die een proton (een H+ ion) in een reactie doneert, en een base als een base die een proton ontvangt. Wanneer het reageert met een sterker zuur, werkt water als een base; wanneer het reageert met een zwakker zuur, werkt het als een zuur. Bijvoorbeeld, het ontvangt een H + ion van HCl in het evenwicht:
HCl + H2O – – – > H3O+ + Cl –
hier werkt water als base door het ontvangen van een H+ – ion. Een zuur doneert een H+ – ion, en water kan dit ook doen, zoals in de reactie met ammoniak, NH3:
NH3 + H2O – – – > NH4 + + OH –
pH in de praktijk
in theorie heeft zuiver water een pH van 7. In de praktijk is zuiver water erg moeilijk te produceren. Water dat gedurende enige tijd aan de lucht wordt blootgesteld, Lost snel kooldioxide op en vormt een oplossing van koolzuur, met een limiterende pH van ~5,7 (referentie: Kendall, J. (1916), Journal of the American Chemical Society 38 (11): 2460-2466).
zuiverend water
gezuiverd water is nodig voor vele industriële toepassingen en voor consumptie. Mensen hebben water nodig dat niet te veel zout of andere onzuiverheden bevat. Veel voorkomende onzuiverheden zijn chemicaliën of schadelijke bacteriën. Sommige opgeloste stoffen zijn aanvaardbaar en zelfs wenselijk voor gepercipieerde smaakversterking. Water dat geschikt is om te drinken wordt drinkbaar water genoemd.
zes populaire methoden voor het zuiveren van water zijn::
- filteren: Water wordt door een zeef geleid die kleine deeltjes vangt. Hoe strakker het gaas van de zeef, hoe kleiner de deeltjes moeten zijn om door te gaan. Filteren is niet voldoende om water volledig te zuiveren, maar het is vaak een noodzakelijke eerste stap, omdat dergelijke deeltjes kunnen interfereren met de grondigere zuiveringsmethoden. Koken: Water wordt lang genoeg tot het kookpunt verhit om micro-organismen die normaal in water bij kamertemperatuur leven, te inactiveren of te doden. In gebieden waar het water “hard” is (met opgeloste calciumzouten), ontleedt het koken het bicarbonaation, waardoor sommige (maar niet alle) opgeloste calcium in de vorm van calciumcarbonaat wordt neergeslagen. Dit is de zogenaamde “bont” die bouwt op ketel elementen etc. in gebieden met hard water. Met uitzondering van calcium verwijdert koken geen opgeloste stoffen met een hoger kookpunt dan water, en verhoogt het in feite de concentratie ervan (doordat wat water als damp verloren gaat)
- koolstoffilter: Houtskool, een vorm van koolstof met een hoog oppervlak als gevolg van de wijze van bereiding, adsorbeert veel verbindingen, waaronder enkele giftige verbindingen. Water wordt door geactiveerde houtskool geleid om dergelijke verontreinigingen te verwijderen. Deze methode wordt het meest gebruikt in huishoudelijke waterfilters en aquaria. Huishoudelijke filters voor drinkwater bevatten soms ook zilver, sporen van zilverionen met een bacteriedodende werking.
- distilleren: bij distillatie wordt het water gekookt om waterdamp te produceren. De waterdamp stijgt dan naar een gekoeld oppervlak waar het terug kan condenseren tot een vloeistof en wordt opgevangen. Omdat de opgeloste stoffen normaal gesproken niet verdampt worden, blijven ze in de kokende oplossing. Zelfs distillatie niet volledig water te zuiveren, als gevolg van verontreinigingen met vergelijkbare kookpunten en druppels van onvervaporiseerde vloeistof gedragen met de stoom. Echter, 99,9% zuiver water kan worden verkregen door destillatie.
- omgekeerde osmose: mechanische druk wordt uitgeoefend op een onzuivere oplossing om zuiver water door een semi-permeabel membraan te drijven. De term is omgekeerde osmose, omdat normale osmose zou resulteren in zuiver water bewegen in de andere richting om de onzuiverheden te verdunnen. Omgekeerde osmose is theoretisch de meest grondige methode van grootschalige waterzuivering beschikbaar, hoewel perfecte semi-doorlaatbare membranen zijn moeilijk te creëren. op uitwisseling chromatografie: In dit geval, wordt het water door een geladen harskolom geleid die zijkettingen heeft die calcium, magnesium, en andere zware metaalionen vangen. In veel laboratoria heeft deze zuiveringsmethode destillatie vervangen, omdat het sneller een hoog volume zeer zuiver water biedt en minder energie verbruikt dan andere processen. Water gezuiverd op deze manier wordt gedeioniseerd water genoemd.
verspillen van Water
verspillen van water is het misbruik van water, dat wil zeggen het onnodig gebruiken. Een voorbeeld hiervan is het gebruik van water, met name water dat gezuiverd is volgens de normen voor veilig drinkwater voor de mens, in onnodige irrigatie. Ook, in huizen, water kan worden verspild als het toilet onnodig wordt gespoeld of de tank lekt. Het veroorzaken van vervuiling van water kan het grootste misbruik van water zijn. Voor zover een verontreinigende stof ander gebruik van het water beperkt, wordt het een verspilling van de hulpbron, ongeacht de voordelen voor de vervuiler.Mythologie
water is een van de vier klassieke elementen samen met vuur, aarde en lucht, en werd beschouwd als de ylem, of basisstof van het universum. Water werd als koud en vochtig beschouwd. In de theorie van de vier lichaamsvocht werd water geassocieerd met slijm. Water was ook een van de vijf elementen in het Chinese Taoïsme, samen met aarde, vuur, hout en metaal.
waterrechten en ontwikkeling
UNESCO ‘ s World Water Development Report (WWDR, 2003) van haar World Water Assessment Program geeft aan dat de wereld in de komende 20 jaar wordt geconfronteerd met een ongekend gebrek aan drinkwater. De hoeveelheid water die voor iedereen beschikbaar is, zal naar verwachting met 30% afnemen. De oorzaken zijn vervuiling, opwarming van de aarde en politieke problemen. Meer dan 2,2 miljoen mensen stierven in 2000 aan ziekten die verband hielden met de consumptie van besmet water. In 2004 meldde de Britse liefdadigheidsinstelling WaterAid dat elke 15 seconden een kind sterft als gevolg van gemakkelijk te voorkomen watergerelateerde ziekten.Uit het verslag blijkt dat er wereldwijd grote verschillen bestaan in het ruwe volume van het beschikbare water: van 10 m3 per persoon per jaar in Koeweit tot 812.121 m3 in Frans-Guyana. Rijkere landen zoals Koeweit kunnen echter gemakkelijker omgaan met de lage waterbeschikbaarheid. In de Verenigde Staten water wet is verdeeld tussen twee juridische doctrines: oeparische waterrechten, gebruikt in de oostelijke en zuidelijke staten waar er een overvloed aan water en de toe-eigening doctrine (of Colorado doctrine) gebruikt in de droge westerse staten.