næste: 6.6 entropi og utilgængelig op: 6. Anvendelser af den foregående: 6.4 Brayton-cyklus i indholdsindeks
overvej et system i kontakt med et varmereservoir under areversible proces. Hvis der er varme ![]() absorberet af thereservoir ved temperatur
absorberet af thereservoir ved temperatur ![]() , ændres reservoirets entropier
, ændres reservoirets entropier ![]() . Generelt er reversible processerledsaget af varmevekslinger, der forekommer på forskellige temperatures.To analyser disse, Vi kan visualisere en sekvens af varmereservoirer ved forskellige temperaturer, så der under en uendelig lille del af cyklussen ikke overføres nogen varme over en endetemperaturforskel.
. Generelt er reversible processerledsaget af varmevekslinger, der forekommer på forskellige temperatures.To analyser disse, Vi kan visualisere en sekvens af varmereservoirer ved forskellige temperaturer, så der under en uendelig lille del af cyklussen ikke overføres nogen varme over en endetemperaturforskel.
under enhver uendelig del vil varme ![]() blive overført mellem systemet og et af reservoirerne, som er på
blive overført mellem systemet og et af reservoirerne, som er på![]() . Hvis
. Hvis ![]() absorberes af systemet, er systemets entropychange
absorberes af systemet, er systemets entropychange
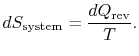
reservoirets entropiændring er
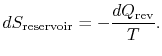
den samlede entropiændring af system plus omgivelser er
dette gælder også, hvis der er en mængde varme afvist afsystem.
konklusionen er, at der for en reversibel proces ikke sker nogen ændring iden samlede entropi produceret, dvs.entropien af systemet plus omgivelserne: ![]() .
.
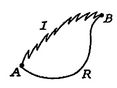
vi udfører nu den samme type analyse for en irreversibelproces, der tager systemet mellem de samme specificerede tilstande som i den reversible proces. Dette vises skematisk ifigur 6.7, med ![]() og
og![]() angiver de irreversible og reversible processer. I deresreversible proces modtager systemet varme
angiver de irreversible og reversible processer. I deresreversible proces modtager systemet varme ![]() og virker
og virker![]() . Ændringen i intern energi til den irreversible proces er
. Ændringen i intern energi til den irreversible proces er
for den reversible proces
fordi tilstandsændringen er den samme i de to processer (vispecificeret at det var), er ændringen i intern energi den samme.Svarende til ændringerne i intern energi i de ovennævnte to udtrykområder
abonnementet `faktisk” refererer til den faktiske proces (som isirreversible). Entropiændringen forbundet med statsændringen er
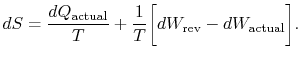 |
(6..3) |
hvis processen ikke er reversibel, opnår vi mindre arbejde end i en reversibel proces,![]() , så for den irreversible proces
, så for den irreversible proces
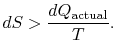
der er ingen lighed mellem entropiændringen![]() ogmængde
ogmængde![]() for en irreversibel proces. Ligestillingen er kungælder for en reversibel proces.
for en irreversibel proces. Ligestillingen er kungælder for en reversibel proces.
ændringen i entropi for enhver proces, der fører til atransformation mellem en indledende tilstand ” a “og en endelig tilstand” b ” er derfor
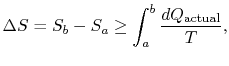
hvor![]() er den varme, der udveksles i den faktiske proces. Ligestillingen gælder kun for en reversibel proces.
er den varme, der udveksles i den faktiske proces. Ligestillingen gælder kun for en reversibel proces.
forskellen ![]() repræsenterer arbejdeVi kunne have opnået, men gjorde det ikke. Det kaldes tabt arbejdeog betegnet med
repræsenterer arbejdeVi kunne have opnået, men gjorde det ikke. Det kaldes tabt arbejdeog betegnet med ![]() . Med hensyn til denne mængde kan viskriv,
. Med hensyn til denne mængde kan viskriv,
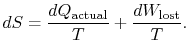 |
(6..4) |
indholdet af ligning (6.4) er detentropi af et system kan ændres på to måder: (i) gennem varmeudveksling og (ii) gennem irreversibiliteter. Det tabte arbejde (![]() i ligning (6.4))er altid større end nul, så den eneste måde at reducere entropien på et system er gennem varmeoverførsel.
i ligning (6.4))er altid større end nul, så den eneste måde at reducere entropien på et system er gennem varmeoverførsel.
for at anvende den anden lov overvejer vi den samlede entropiændring (systemplus omgivelser). Hvis omgivelserne er et reservoir påtemperatur ![]() , som systemet udveksler varme med,
, som systemet udveksler varme med,

den samlede entropiændring er
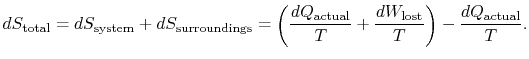
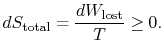
mængden (![]() ) er entropien genereret på grund afirreversibilitet.
) er entropien genereret på grund afirreversibilitet.
endnu en måde at angive den skelnen, vi laver, er
| (6..5) |
det tabte arbejde kaldes også spredning og noteret![]() . Ved hjælp af denne notation, den uendelige entropiændring af systemetbliver:
. Ved hjælp af denne notation, den uendelige entropiændring af systemetbliver:
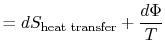 |
||
| eller | ||
ligning (6.5) kan også skrives som arate ligning,
 |
(6..6) |
enten af ligning (6.5) eller (6.6) kan fortolkes til at betyde, at systemets entropi,![]() , påvirkes af to faktorer: strømmen afvarme
, påvirkes af to faktorer: strømmen afvarme![]() og udseendet af yderligere entropi, betegnet med
og udseendet af yderligere entropi, betegnet med![]() på grund af irreversibilitet6.1. Denne ekstra entropi er nul, nårprocessen er reversibel og altid positiv, når processen erirreversibel. Således kan man sige, at systemet udvikler sigkilder, der skaber entropi under en irreversibel proces.Den anden lov hævder, at dræn af entropi er umuligei naturen, hvilket er en mere grafisk måde at sige, at
på grund af irreversibilitet6.1. Denne ekstra entropi er nul, nårprocessen er reversibel og altid positiv, når processen erirreversibel. Således kan man sige, at systemet udvikler sigkilder, der skaber entropi under en irreversibel proces.Den anden lov hævder, at dræn af entropi er umuligei naturen, hvilket er en mere grafisk måde at sige, at![]() og
og![]() er positive bestemte(altid større end nul) eller nul i det særlige tilfælde afreversible processer.
er positive bestemte(altid større end nul) eller nul i det særlige tilfælde afreversible processer.
udtrykket
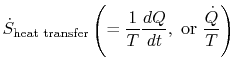
som er forbundet med varmeoverførsel til systemet, kan fortolkes som en strøm af entropi. Grænsen krydses af varmeog forholdet mellem denne varmestrøm og temperatur kan defineres som entropi. Der er ingen begrænsninger på tegn på dettemængde, og vi kan sige,at denne strøm enten bidrager til eller dræner væk systemets entropi. Under en reversibel proces kan kun denne strømning påvirke systemets entropi. Detteterminologi antyder, at vi fortolker entropi som en slagsvægtløs væske, hvis mængde bevares (som materiens)under en reversibel proces. Under en irreversibel proces bevares denne væske imidlertid ikke; den kan ikke forsvinde, mensnarere er skabt af kilder i hele systemet. Selvom denne fortolkning ikke bør tages for bogstaveligt, giver den en let udtryksform og er i samme kategori af begreber som dem, der er forbundet med sætningerne `strøm af energi” eller `kilder til varme.”I væskemekanik er for eksempel dette grafiske sprogmeget effektiv, og der bør ikke være nogen indvendinger mod at kopiere det itermodynamik.
Muddy Points
ser vi nogensinde en absolut variabel for entropi? Indtil videre har viarbejdede kun med deltager (MP 6.8)
jeg er forvirret over ![]() i modsætning til
i modsætning til ![]() .(MP 6.9)
.(MP 6.9)
for irreversible processer, Hvordan kan vi beregne ![]() hvis ikke ligetil
hvis ikke ligetil ![]() ?(MP 6.10)
?(MP 6.10)
næste: 6.6 entropi og utilgængelig op: 6. Anvendelser af den foregående: 6.4 Brayton cyklus i Indhold Indeks
UnifiedTP