nästa: 6.6 entropi och otillgänglig upp: 6. Tillämpningar av föregående: 6.4 Brayton-cykeln i innehållsindex
Tänk på ett system som är i kontakt med en värmebehållare under areversibel process. Om det finns värme ![]() absorberas avreservoar vid temperatur
absorberas avreservoar vid temperatur ![]() , förändringen i entropi av reservoarenär
, förändringen i entropi av reservoarenär ![]() . I allmänhet är reversibla processeråtföljd av värmeväxlingar som uppträder vid olika temperatures.To analysera dessa, vi kan visualisera en sekvens av värmebehållare vid olika temperaturer så att under någon oändlig del av cykeln kommer det inte att finnas någon värme överförd över en ändtemperaturskillnad.
. I allmänhet är reversibla processeråtföljd av värmeväxlingar som uppträder vid olika temperatures.To analysera dessa, vi kan visualisera en sekvens av värmebehållare vid olika temperaturer så att under någon oändlig del av cykeln kommer det inte att finnas någon värme överförd över en ändtemperaturskillnad.
under någon oändlig del, värme ![]() kommer att överföras mellan systemet och en av reservoarerna som är vid
kommer att överföras mellan systemet och en av reservoarerna som är vid![]() . Om
. Om ![]() absorberas av systemet, är systemets entropyförändring
absorberas av systemet, är systemets entropyförändring
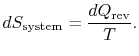
reservoarens entropiförändring är
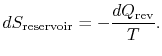
den totala entropiförändringen av system plus omgivningar är
detta är också sant om det finns en mängd värme som avvisas av systemet.
slutsatsen är att för en reversibel process sker ingen förändring iden totala entropin som produceras, dvs systemets entropi plus omgivningensentropi: ![]() .
.
vi utför nu samma typ av analys för en irreversibelprocess, som tar systemet mellan samma specificerade tillstånd somi den reversibla processen. Detta visas schematiskt ifigur 6.7, med ![]() och
och![]() betecknar de irreversibla och reversibla processerna. I derasreversibel process mottar systemet värme
betecknar de irreversibla och reversibla processerna. I derasreversibel process mottar systemet värme ![]() och fungerar
och fungerar![]() . Förändringen i intern energi för den irreversibla processen är
. Förändringen i intern energi för den irreversibla processen är
för den reversibla processen
eftersom tillståndsförändringen är densamma i de två processerna (vispecificerat att det var) är förändringen i intern energi densamma.Likställa förändringarna i intern energi i ovanstående två uttryckfält
prenumerationen ”faktisk” avser den faktiska processen (som ärirreversibel). Entropiförändringen i samband med tillståndsförändringenär
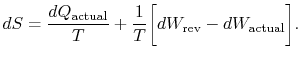 |
(6..3) |
om processen inte är reversibel får vi mindre arbete (se IAWnotes) än i en reversibel process,![]() , så att för den irreversibla processen,
, så att för den irreversibla processen,
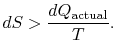
det finns ingen jämlikhet mellan entropiförändringen![]() och thequantity
och thequantity![]() för en irreversibel process. Jämställdheten är endasttillämplig för en reversibel process.
för en irreversibel process. Jämställdheten är endasttillämplig för en reversibel process.
förändringen i entropi för varje process som leder till atransformation mellan ett initialt tillstånd `a” och ett slutligt tillstånd`b” är därför
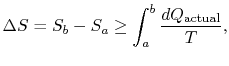
där![]() är den värme som utbyts i själva verketprocess. Jämställdheten gäller endast en reversibel process.
är den värme som utbyts i själva verketprocess. Jämställdheten gäller endast en reversibel process.
skillnaden ![]() representerar arbetevi kunde ha fått, men gjorde det inte. Det kallas förlorat arbeteoch betecknas med
representerar arbetevi kunde ha fått, men gjorde det inte. Det kallas förlorat arbeteoch betecknas med ![]() . När det gäller denna kvantitet kan viskriv,
. När det gäller denna kvantitet kan viskriv,
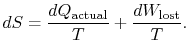 |
(6..4) |
innehållet i ekvationen (6.4) är detentropin av ett system kan ändras på två sätt: (i) genom värmeutbyte och (ii) genom irreversibiliteter. Det förlorade arbetet (![]() i ekvation (6.4))är alltid större än noll, så det enda sättet att minska entropin av ett system är genom värmeöverföring.
i ekvation (6.4))är alltid större än noll, så det enda sättet att minska entropin av ett system är genom värmeöverföring.
för att tillämpa den andra lagen anser vi den totala entropiförändringen (systemplus omgivning). Om omgivningen är en reservoar vidtemperatur ![]() , med vilken systemet utbyter värme,
, med vilken systemet utbyter värme,

den totala entropiförändringen är
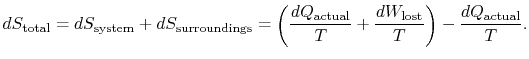
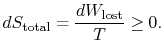
kvantiteten (![]() ) är den entropi som genereras på grund avirreversibilitet.
) är den entropi som genereras på grund avirreversibilitet.
ännu ett sätt att ange skillnaden vi gör är
| (6..5) |
det förlorade arbetet kallas också spridning och noteras![]() . Med hjälp av denna notation, den oändliga entropiförändringen av systemetblir:
. Med hjälp av denna notation, den oändliga entropiförändringen av systemetblir:
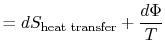 |
||
| eller | ||
ekvation (6.5) kan också skrivas som arate ekvation,
 |
(6..6) |
endera av ekvation (6.5) eller(6.6) kan tolkas så att systemets entropi,![]() , påverkas av två faktorer: flödet avvärme
, påverkas av två faktorer: flödet avvärme![]() och utseendet av ytterligare entropi, betecknad med
och utseendet av ytterligare entropi, betecknad med![]() , på grund av irreversibilitet6.1. Denna ytterligare entropi är noll när processen är reversibel och alltid positiv när processen är oreversibel. Således kan man säga att systemet utvecklaskällor som skapar entropi under en irreversibel process.Den andra lagen hävdar att sänkor av entropi är omöjligai naturen, vilket är ett mer grafiskt sätt att säga att
, på grund av irreversibilitet6.1. Denna ytterligare entropi är noll när processen är reversibel och alltid positiv när processen är oreversibel. Således kan man säga att systemet utvecklaskällor som skapar entropi under en irreversibel process.Den andra lagen hävdar att sänkor av entropi är omöjligai naturen, vilket är ett mer grafiskt sätt att säga att![]() och
och![]() är positiva bestämda(alltid större än noll) eller noll i det speciella falletreversibla processer.
är positiva bestämda(alltid större än noll) eller noll i det speciella falletreversibla processer.
termen
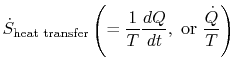
som är associerad med värmeöverföring till systemet, kan tolkas som ett flöde av entropi. Gränsen korsas av värmeoch förhållandet mellan detta värmeflöde och temperatur kan definieras som aflux av entropi. Det finns inga begränsningar på tecknet på dettakvantitet, och vi kan säga att detta flöde antingen bidrar till eller dränerar bort systemets entropi. Under en reversibel process kan endast detta flöde påverka systemets entropi. Dettaterminologi föreslår att vi tolkar entropi som en slagsviktlös vätska, vars kvantitet bevaras (som materiens)under en reversibel process. Under en irreversibel process bevaras emellertid inte denna vätska, den kan inte försvinna, mensnarare skapas av källor i hela systemet. Även om dettatolkning inte bör tas för bokstavligt, det ger enlätt uttryckssätt och ligger i samma kategori av begrepp som de som är associerade med fraserna `flöde av energi” eller `källorav värme.”I fluidmekanik är till exempel detta grafiska språkmycket effektivt och det borde inte finnas några invändningar mot att kopiera det itermodynamik.
Muddy Points
ser vi någonsin en absolut variabel för entropi? Hittills har vi endast arbetat med deltas (MP 6.8)
jag är förvirrad att ![]() i motsats till
i motsats till ![]() .(MP 6.9)
.(MP 6.9)
för irreversibla processer, hur kan vi beräkna ![]() om inte equalto
om inte equalto ![]() ?(MP 6.10)
?(MP 6.10)
nästa: 6.6 entropi och otillgänglig upp: 6. Tillämpningar av föregående: 6.4 Brayton-cykel i innehållsindex
UnifiedTP