următor: 6.6 entropie și indisponibil în sus: 6. Aplicații ale precedentului: 6.4 ciclul Brayton în Cuprins Index
luați în considerare un sistem în contact cu un rezervor de căldură în timpul procesului areversible. Dacă există căldură![]() absorbită de rezervor la temperatura
absorbită de rezervor la temperatura![]() , modificarea entropiei rezervoruluieste
, modificarea entropiei rezervoruluieste![]() . În general, procesele reversibile suntînsoțite de schimburi de căldură care apar la diferite temperatures.To analizați-le, putem vizualiza o secvență de rezervoare de căldură la temperaturi diferite, astfel încât în timpul oricărei porțiuni infinitezimale a ciclului să nu existe căldură transferată pe o diferență de temperatură finală.
. În general, procesele reversibile suntînsoțite de schimburi de căldură care apar la diferite temperatures.To analizați-le, putem vizualiza o secvență de rezervoare de căldură la temperaturi diferite, astfel încât în timpul oricărei porțiuni infinitezimale a ciclului să nu existe căldură transferată pe o diferență de temperatură finală.
în timpul oricărei porțiuni infinitezimale, căldura ![]() va fi transferată între sistem și unul dintre rezervoare, care este la
va fi transferată între sistem și unul dintre rezervoare, care este la![]() . Dacă
. Dacă ![]() este absorbit de sistem, entropychange a sistemului este
este absorbit de sistem, entropychange a sistemului este
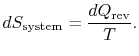
schimbarea entropiei rezervorului este
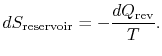
schimbarea entropiei totale a sistemului Plus împrejurimile este
acest lucru este valabil și dacă există o cantitate de căldură respinsă de sistem.
concluzia este că, pentru un proces reversibil, nu se produce nicio modificare în Entropia totală produsă, adică entropia sistemului plus entropia împrejurimilor: ![]() .
.
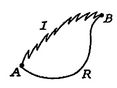
acum efectuăm același tip de analiză pentru un proces ireversibil, care ia sistemul între aceleași stări specificate caîn procesul reversibil. Acest lucru este prezentat schematic înfigura 6.7, cu![]() și
și![]() care denotă procesele ireversibile și reversibile. În procesul lor reversibil, sistemul primește căldură
care denotă procesele ireversibile și reversibile. În procesul lor reversibil, sistemul primește căldură ![]() și funcționează
și funcționează![]() . Schimbarea energiei interne pentru procesul ireversibil este
. Schimbarea energiei interne pentru procesul ireversibil este
pentru procesul reversibil
deoarece schimbarea stării este aceeași în cele două procese (amspecificat că a fost), schimbarea energiei interne este aceeași.Echivalând modificările energiei interne în cele două expresii de mai suscâmpuri
indicele `real” se referă la procesul real (care este ireversibil). Schimbarea entropiei asociată cu schimbarea de stateste
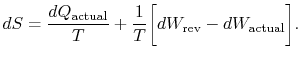 |
(6..3) |
dacă procesul nu este reversibil, obținem mai puțină muncă (Vezi IAWnotes) decât într-un proces reversibil,![]() , astfel încât pentru procesul ireversibil,
, astfel încât pentru procesul ireversibil,
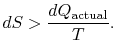
nu există egalitate între schimbarea entropiei![]() și suma
și suma![]() pentru un proces ireversibil. Egalitatea este aplicabilă numai pentru un proces reversibil.
pentru un proces ireversibil. Egalitatea este aplicabilă numai pentru un proces reversibil.
schimbarea entropiei pentru orice proces care duce la atransformare între o stare inițială „a`și o stare finală” b ” este, prin urmare
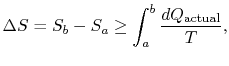
unde![]() este căldura schimbată în procesul actual. Egalitatea se aplică numai unui proces reversibil.
este căldura schimbată în procesul actual. Egalitatea se aplică numai unui proces reversibil.
diferența ![]() reprezintă munca pe care am fi putut să o obținem, dar nu am făcut-o. Este denumită muncă pierdută și notată cu
reprezintă munca pe care am fi putut să o obținem, dar nu am făcut-o. Este denumită muncă pierdută și notată cu ![]() . În ceea ce privește această cantitate, putemscrie,
. În ceea ce privește această cantitate, putemscrie,
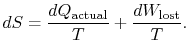 |
(6..4) |
conținutul ecuației (6.4) este că entropia unui sistem poate fi modificată în două moduri: (i) prin schimb de căldură și (ii) prin ireversibilități. Lucrarea pierdută (![]() în ecuația (6.4))este întotdeauna mai mare decât zero, deci singura modalitate de a reduce entropia unui sistem este prin transferul de căldură.
în ecuația (6.4))este întotdeauna mai mare decât zero, deci singura modalitate de a reduce entropia unui sistem este prin transferul de căldură.
pentru a aplica a doua lege, considerăm schimbarea entropiei totale (systemplus environments). Dacă împrejurimile sunt un rezervor latemperatura ![]() , cu care sistemul schimbă căldura,
, cu care sistemul schimbă căldura,

schimbarea entropiei totale este
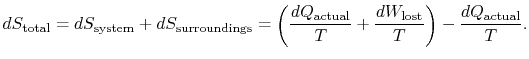
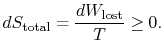
cantitatea (![]() ) este entropia generată datorităirversibilitate.
) este entropia generată datorităirversibilitate.
un alt mod de a afirma distincția pe care o facem este
| (6..5) |
lucrarea pierdută se mai numește disipare și se notează![]() . Folosind această notație, schimbarea entropiei infinitezimale a sistemuluidevine:
. Folosind această notație, schimbarea entropiei infinitezimale a sistemuluidevine:
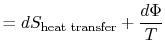 |
||
| sau | ||
ecuație (6.5) poate fi, de asemenea, scris ca ecuația arat,
 |
(6..6) |
oricare dintre ecuațiile (6.5) sau(6.6) poate fi interpretată în sensul că entropia sistemului,![]() , este afectată de doi factori: fluxul de căldură
, este afectată de doi factori: fluxul de căldură![]() și apariția entropiei suplimentare, notată cu
și apariția entropiei suplimentare, notată cu![]() , datorită ireversibilității6.1. Această entropie suplimentară este zero atunci când procesul este reversibil și întotdeauna pozitiv atunci când procesul este ireversibil. Astfel, se poate spune că sistemul se dezvoltăsurse care creează entropie în timpul unui proces ireversibil.A doua lege afirmă că chiuvetele entropiei sunt imposibile în natură, ceea ce este un mod mai Grafic de a spune că
, datorită ireversibilității6.1. Această entropie suplimentară este zero atunci când procesul este reversibil și întotdeauna pozitiv atunci când procesul este ireversibil. Astfel, se poate spune că sistemul se dezvoltăsurse care creează entropie în timpul unui proces ireversibil.A doua lege afirmă că chiuvetele entropiei sunt imposibile în natură, ceea ce este un mod mai Grafic de a spune că![]() și
și![]() sunt pozitive definite(întotdeauna mai mari decât zero) sau zero în cazul special al proceselor reversibile.
sunt pozitive definite(întotdeauna mai mari decât zero) sau zero în cazul special al proceselor reversibile.
termenul
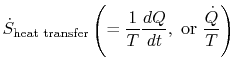
care este asociat cu transferul de căldură în sistem, poate fi interpretat ca un flux de entropie. Limita este traversată de căldurăiar raportul dintre acest flux de căldură și temperatură poate fi definit ca aflux de entropie. Nu există restricții asupra semnului acestui lucrucantitate și putem spune că acest flux contribuie fie la,fie la drenarea entropiei sistemului. În timpul unui proces reversibil, numai acest flux poate afecta entropia sistemului. Thisterminology sugerează că interpretăm entropia ca un fel de fluid fără greutate, a cărui cantitate este conservată (ca cea a materiei)în timpul unui proces reversibil. Cu toate acestea,în timpul unui proces ireversibil, acest fluid nu este conservat; nu poate dispărea, ci mai degrabă este creat de surse din întregul sistem. În timp ce această interpretare nu ar trebui luată prea literal, oferă un mod ușor de exprimare și se află în aceeași categorie de concepte, cum ar fi cele asociate cu frazele `flux de energie” sau `surse de căldură.”În mecanica fluidelor, de exemplu, acest limbaj grafic estefoarte eficient și nu ar trebui să existe obiecții cu privire la copierea acestuia întermodinamică.
puncte noroioase
vedem vreodată o variabilă absolută pentru entropie? Până acum, am lucrat doar cu delte (MP 6.8)
sunt confuz cu privire la ![]() spre deosebire de
spre deosebire de ![]() .(MP 6.9)
.(MP 6.9)
pentru procese ireversibile, cum putem calcula ![]() dacă nu egalla
dacă nu egalla ![]() ?(MP 6.10)
?(MP 6.10)
următor: 6.6 entropie și indisponibil în sus: 6. Aplicațiile anterioare: 6.4 ciclul Brayton în Cuprins Index
UnifiedTP