volgende: 6.6 entropie en niet beschikbaar omhoog: 6. Toepassingen van de vorige: 6.4 Brayton cyclus in inhoudsindex
overweeg een systeem in contact met een warmtereservoir tijdens een uitvoerbaar proces. Indien de warmte ![]() door de reservoir wordt geabsorbeerd bij een temperatuur
door de reservoir wordt geabsorbeerd bij een temperatuur ![]() , dan wordt de entropie van de reservoirs
, dan wordt de entropie van de reservoirs ![]() gewijzigd. In het algemeen worden omkeerbare processen gecombineerd met warmte-uitwisseling die plaatsvindt bij verschillende temperatures.To analyseer deze, we kunnen visualiseren een opeenvolging van warmte reservoirs bij verschillende temperaturen, zodat tijdens een oneindig klein gedeelte van de cyclus zal er geen warmte overgedragen over een eindige temperatuurverschil.
gewijzigd. In het algemeen worden omkeerbare processen gecombineerd met warmte-uitwisseling die plaatsvindt bij verschillende temperatures.To analyseer deze, we kunnen visualiseren een opeenvolging van warmte reservoirs bij verschillende temperaturen, zodat tijdens een oneindig klein gedeelte van de cyclus zal er geen warmte overgedragen over een eindige temperatuurverschil.
gedurende een oneindig klein gedeelte zal warmte ![]() worden overgedragen tussen het systeem en een van de reservoirs die op
worden overgedragen tussen het systeem en een van de reservoirs die op![]() staat. Als
staat. Als ![]() door het systeem wordt geabsorbeerd, is de entropychange van het systeem
door het systeem wordt geabsorbeerd, is de entropychange van het systeem
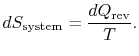
de entropieverandering van het reservoir is
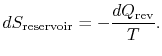
de totale entropieverandering van systeem plus omgeving is
dit geldt ook als er een hoeveelheid warmte door het systeem wordt afgekeurd.
de conclusie is dat er bij een omkeerbaar proces geen verandering optreedt in de totale geproduceerde entropie, d.w.z. de entropie van het systeem plus de entropie van de omgeving: ![]() .
.
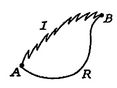
we voeren nu hetzelfde type analyse uit voor een onomkeerbaar proces, waarbij het systeem tussen dezelfde gespecificeerde toestanden wordt gebracht als in het omkeerbare proces. Dit wordt schematisch weergegeven inFigure 6.7, waarbij ![]() en
en![]() de irreversibele en reversibele processen aangeven. In het reversible proces ontvangt het systeem warmte
de irreversibele en reversibele processen aangeven. In het reversible proces ontvangt het systeem warmte ![]() en werkt het
en werkt het![]() . De verandering in interne energie voor het onomkeerbare proces is
. De verandering in interne energie voor het onomkeerbare proces is
voor het omkeerbare proces
omdat de toestandsverandering in de twee processen hetzelfde is( wespeciified dat het was), is de verandering in interne energie hetzelfde.Gelijkstelling van de veranderingen in interne energie in de bovenstaande twee expressievelden
het subscript “actual” verwijst naar het werkelijke proces (dat reversible is). De entropieverandering in verband met de statuswijziging is
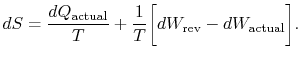 |
(6..3) |
als het proces niet omkeerbaar is, krijgen we minder werk (zie IAWnotes) dan in een omkeerbaar proces,![]() , zodat voor het onomkeerbare proces,
, zodat voor het onomkeerbare proces,
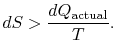
er is geen gelijkheid tussen de entropieverandering![]() en de hoeveelheid
en de hoeveelheid![]() voor een onomkeerbaar proces. De gelijkheid is alleen van toepassing op een omkeerbaar proces.
voor een onomkeerbaar proces. De gelijkheid is alleen van toepassing op een omkeerbaar proces.
de verandering in entropie voor elk proces dat leidt tot atransformatie tussen een begintoestand ” a “en een eindtoestand” b ” is daarom
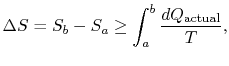
waarbij![]() de warmte is die wordt uitgewisseld in het werkelijke proces. De gelijkheid geldt alleen voor een omkeerbaar proces.
de warmte is die wordt uitgewisseld in het werkelijke proces. De gelijkheid geldt alleen voor een omkeerbaar proces.
het verschil ![]() vertegenwoordigt werk dat we hadden kunnen verkrijgen, maar dat niet deed. Het wordt aangeduid als verloren werk en aangeduid met
vertegenwoordigt werk dat we hadden kunnen verkrijgen, maar dat niet deed. Het wordt aangeduid als verloren werk en aangeduid met ![]() . In termen van deze hoeveelheid kunnen we schrijven,
. In termen van deze hoeveelheid kunnen we schrijven,
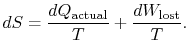 |
(6..4) |
de inhoud van vergelijking (6.4) is dat de entropie van een systeem op twee manieren kan worden gewijzigd: (I) door heatexchange en (ii) door irreversibilities. Het verloren werk (![]() in vergelijking (6.4)) is altijd groter dan nul, dus de enige manier om de entropie van een systeem te verminderen is door warmteoverdracht.
in vergelijking (6.4)) is altijd groter dan nul, dus de enige manier om de entropie van een systeem te verminderen is door warmteoverdracht.
bij de toepassing van de tweede wet wordt rekening gehouden met de totale entropieverandering (systeemplus omgeving). Indien de omgeving een reservoir is met een temperatuur ![]() , waarmee het systeem warmte uitwisselt,
, waarmee het systeem warmte uitwisselt,

de totale entropieverandering is
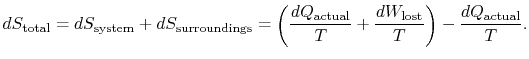
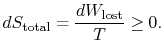
de hoeveelheid (![]() ) is de entropie die wordt gegenereerd vanwege irreversibiliteit.
) is de entropie die wordt gegenereerd vanwege irreversibiliteit.
nog een andere manier om het onderscheid te maken dat we maken is
| (6..5) |
het verloren werk wordt ook wel dissipatie genoemd en genoteerd![]() . Usingthis notatie, de infinitesimale entropie verandering van de systembecomes:
. Usingthis notatie, de infinitesimale entropie verandering van de systembecomes:
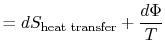 |
||
| of | ||
vergelijking (6.5) kan ook worden geschreven als arate-vergelijking,
 |
(6..6) |
beide van vergelijking (6.5) of (6.6) kunnen zo worden geïnterpreteerd dat de entropie van het systeem,![]() , wordt beïnvloed door twee factoren: de stroom van warmte
, wordt beïnvloed door twee factoren: de stroom van warmte![]() en het verschijnen van extra entropie, aangeduid met
en het verschijnen van extra entropie, aangeduid met![]() , als gevolg van irreversibility6.1. Deze extra entropie is nul wanneer het proces reversibel is en altijd positief wanneer het proces reversibel is. Zo kan men zeggen dat het systeem middelen ontwikkelt die entropie creëren tijdens een onomkeerbaar proces.De tweede wet stelt dat sinks van entropie onmogelijk zijn in de natuur, wat een meer grafische manier is om te zeggen dat
, als gevolg van irreversibility6.1. Deze extra entropie is nul wanneer het proces reversibel is en altijd positief wanneer het proces reversibel is. Zo kan men zeggen dat het systeem middelen ontwikkelt die entropie creëren tijdens een onomkeerbaar proces.De tweede wet stelt dat sinks van entropie onmogelijk zijn in de natuur, wat een meer grafische manier is om te zeggen dat![]() en
en![]() positief definitief zijn (altijd groter dan nul), of nul in het speciale geval van reversible processen.
positief definitief zijn (altijd groter dan nul), of nul in het speciale geval van reversible processen.
de term
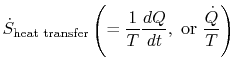
die geassocieerd is met warmteoverdracht naar het systeem, kan worden geïnterpreteerd als een flux van entropie. De grens wordt overschreden door warmte en de verhouding van deze warmteflux tot temperatuur kan worden gedefinieerd als aflux van entropie. Er zijn geen beperkingen op het teken van deze kwantiteit,en we kunnen zeggen dat deze flux bijdraagt aan, of wegvoert, de entropie van het systeem. Tijdens een omkeerbaar proces kan alleen deze flux de entropie van het systeem beïnvloeden. Deze sterminologie suggereert dat we entropie interpreteren als een soort gewichtloze vloeistof, waarvan de hoeveelheid behouden wordt (zoals die van materie)tijdens een reversibel proces. Tijdens een onomkeerbaar proces wordt deze vloeistof echter niet bewaard; het kan niet verdwijnen, maar wordt weer gecreëerd door bronnen in het hele systeem. Hoewel deze interpretatie niet al te letterlijk moet worden genomen, biedt zij een gemakkelijke wijze van uitdrukking en valt zij onder dezelfde categorie begrippen als die welke verband houden met de uitdrukkingen `stroom van energie” of `bronnen van warmte.”In de vloeistofmechanica, bijvoorbeeld, is deze grafische taal zeer effectief en er mag geen bezwaar zijn tegen het kopiëren ervan in de thermodynamica.
modderige punten
zien we ooit een absolute variabele voor entropie? Tot nu toe hebben we alleen met delta ‘ s gewerkt (MP 6.8)
ik ben verward met ![]() in tegenstelling tot
in tegenstelling tot ![]() .(MP 6.9)
.(MP 6.9)
voor irreversibele processen, hoe kunnen we ![]() berekenen als het niet gelijk is aan
berekenen als het niet gelijk is aan ![]() ?(MP 6.10)
?(MP 6.10)
volgende: 6.6 entropie en niet beschikbaar omhoog: 6. Toepassingen van de vorige: 6.4 Brayton cyclus in inhoudsindex
UnifiedTP