Siguiente: 6.6 Entropía y No disponible Subir: 6. Aplicaciones del Ciclo de Brayton anterior: 6.4 en Índice de contenido
Considere un sistema en contacto con un depósito de calor durante un proceso reversible. Si hay calor ![]() absorbido por thereservoir a una temperatura de
absorbido por thereservoir a una temperatura de ![]() , el cambio en la entropía de la reservoiris
, el cambio en la entropía de la reservoiris ![]() . En general, los procesos reversibles van acompañados de intercambios de calor que se producen en temperatures.To al analizarlos, podemos visualizar una secuencia de depósitos de calor a diferentes temperaturas para que durante cualquier porción infinitesimal del ciclo no haya transferencia de calor sobre una diferencia de temperatura final.
. En general, los procesos reversibles van acompañados de intercambios de calor que se producen en temperatures.To al analizarlos, podemos visualizar una secuencia de depósitos de calor a diferentes temperaturas para que durante cualquier porción infinitesimal del ciclo no haya transferencia de calor sobre una diferencia de temperatura final.
Durante cualquier porción infinitesimal, el calor ![]() es absorbido por el sistema, el entropychange del sistema es
es absorbido por el sistema, el entropychange del sistema es
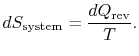
El cambio de entropía del depósito es
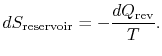
El cambio de entropía total del sistema más el entorno es
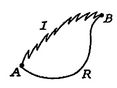
Ahora realizamos el mismo tipo de análisis para un proceso irreversible, que toma el sistema entre los mismos estados especificados como en el proceso reversible. Esto se muestra esquemáticamente en la figura 6.7, con ![]()
Para el proceso reversible
El subíndice «actual» se refiere al proceso real (que es reversible). El cambio de entropía asociado con el cambio de estado es
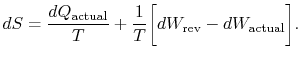 |
(6..3) |
Si el proceso no es reversible, obtenemos menos trabajo (ver notas IAW) que en un proceso reversible, ![]() , de modo que para el proceso irreversible,
, de modo que para el proceso irreversible,
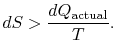
No hay igualdad entre el cambio de entropía ![]()
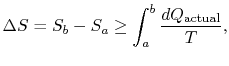 es el calor intercambiado en el proceso actual. La igualdad solo se aplica a un proceso reversible.
es el calor intercambiado en el proceso actual. La igualdad solo se aplica a un proceso reversible.
La diferencia ![]() representa el trabajo que podríamos haber obtenido, pero no lo hicimos. Se conoce como trabajo perdido y se denota por
representa el trabajo que podríamos haber obtenido, pero no lo hicimos. Se conoce como trabajo perdido y se denota por ![]()
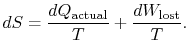
El contenido de la ecuación (6.4) es que la entropía de un sistema puede alterarse de dos maneras: (i) a través del cambio de calor y (ii) a través de irreversibilidad. El trabajo perdido (![]() en la ecuación (6.4))es siempre mayor que cero, por lo que la única manera de disminuir la entropía de un sistema es a través de la transferencia de calor.
en la ecuación (6.4))es siempre mayor que cero, por lo que la única manera de disminuir la entropía de un sistema es a través de la transferencia de calor.
Para aplicar la segunda ley consideramos el cambio de entropía total (entorno systeplus). Si el entorno es una temperatura de depósito ![]() El cambio de entropía total es
El cambio de entropía total es
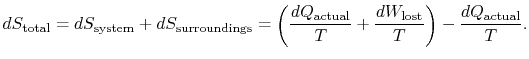
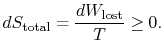
La cantidad (![]() ) es la entropía generada debido a su reversibilidad.
) es la entropía generada debido a su reversibilidad.
Otra forma de establecer la distinción que estamos haciendo es
| (6..5) |
El trabajo perdido también se llama disipación y se nota ![]()
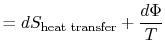
Ecuación (6.5) también se puede escribir como ecuación de arate,
 |
(6..6) |
Cualquiera de la Ecuación (6.5) o(6.6) puede ser interpretada en el sentido de que theentropy del sistema, ![]() , se ve afectada por dos factores: el flujo de ofheat
, se ve afectada por dos factores: el flujo de ofheat ![]() y la aparición de entropía adicional, representada por
y la aparición de entropía adicional, representada por![]() , debido a irreversibility6.1. Esta entropía adicional es cero cuando el proceso es reversible y siempre positiva cuando el proceso es reversible. Así, se puede decir que el sistema desarrolla fuentes que crean entropía durante un proceso irreversible.La segunda ley afirma que los sumideros de entropía son imposibles en la naturaleza, lo que es una forma más gráfica de decir que
, debido a irreversibility6.1. Esta entropía adicional es cero cuando el proceso es reversible y siempre positiva cuando el proceso es reversible. Así, se puede decir que el sistema desarrolla fuentes que crean entropía durante un proceso irreversible.La segunda ley afirma que los sumideros de entropía son imposibles en la naturaleza, lo que es una forma más gráfica de decir que![]()
Puntos fangosos
¿Alguna vez vemos una variable absoluta para la entropía? Hasta ahora, solo hemos trabajado con deltas (MP 6.8)
estoy confundido en cuanto a ![]() frente a
frente a ![]() .(MP 6.9)
.(MP 6.9)
Para procesos irreversibles, ¿cómo podemos calcular ![]()
![]()
![]()
![]()
![]()
Siguiente: 6.6 Entropía y No disponible Subir: 6. Aplicaciones del Ciclo de Brayton anterior: 6.4 en Índice de contenido UnifiedTP