Neste: 6.6 Entropi Og Utilgjengelig Opp: 6. Anvendelser Av Forrige: 6.4 Brayton Syklus I Innhold Index
Vurdere et system i kontakt med et varmereservoar under areversible prosessen. Hvis det er varme ![]() absorbert av reservoir ved temperatur
absorbert av reservoir ved temperatur ![]() , endres reservoarets entropi
, endres reservoarets entropi ![]() . Generelt er reversible prosesserledsaget av varmeveksling som forekommer ved forskjellige temperatures.To analysere disse, kan vi visualisere en sekvens av varme reservoarer atforskjellige temperaturer slik at i løpet av en uendelig del av syklusen vil det ikke være noen varme overføres over en finitetemperaturforskjell.
. Generelt er reversible prosesserledsaget av varmeveksling som forekommer ved forskjellige temperatures.To analysere disse, kan vi visualisere en sekvens av varme reservoarer atforskjellige temperaturer slik at i løpet av en uendelig del av syklusen vil det ikke være noen varme overføres over en finitetemperaturforskjell.
under en uendelig del vil varme ![]() overføre mellom systemet og en av reservoarene som er på
overføre mellom systemet og en av reservoarene som er på![]() . Hvis
. Hvis![]() absorberes av systemet, er entropychange av systemet
absorberes av systemet, er entropychange av systemet
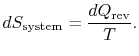
entropiendringen av reservoaret er
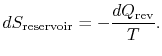
den totale entropiendringen av system pluss omgivelser er
Dette gjelder også hvis det er en mengde varme avvist av systemet.
konklusjonen er at for en reversibel prosess skjer ingen endring i total entropi produsert, dvs. entropi av systemet pluss entropi av omgivelsene: ![]() .
.
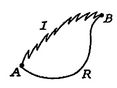
Vi utfører nå samme type analyse for en irreversibelprosess, som tar systemet mellom de samme spesifiserte tilstandene somi reversibel prosess. Dette vises skjematisk ifigur 6.7, med ![]() og
og![]() betegner de irreversible og reversible prosessene. I sin reversible prosess mottar systemet varme
betegner de irreversible og reversible prosessene. I sin reversible prosess mottar systemet varme ![]() og fungerer
og fungerer![]() . Endringen i intern energi for den irreversible prosessen er
. Endringen i intern energi for den irreversible prosessen er
for den reversible prosessen
fordi tilstandsendringen er den samme i de to prosessene (vispesifisert at den var), er endringen i intern energi den samme.Tilsvarer endringene i intern energi i de ovennevnte to uttrykkenefelt
abonnementet» faktisk » refererer til den faktiske prosessen (som isirreversible). Entropiendringen knyttet til statsendringener
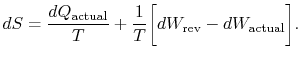 |
(6..3) |
hvis prosessen ikke er reversibel, får vi mindre arbeid (se IAWnotes) enn i en reversibel prosess,![]() , slik at for den irreversible prosessen,
, slik at for den irreversible prosessen,
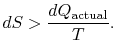
det er ingen likestilling mellom entropiendringen![]() og kvantitet
og kvantitet![]() for en irreversibel prosess. Likestilling er baregjelder for en reversibel prosess.
for en irreversibel prosess. Likestilling er baregjelder for en reversibel prosess.
endringen i entropi for enhver prosess som fører til atransformasjon mellom en innledende tilstand `a» og en endelig tilstand`b» er derfor
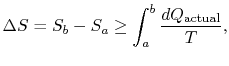
hvor![]() er varmen utvekslet i den faktiske prosessen. Likestilling gjelder bare for en reversibel prosess.
er varmen utvekslet i den faktiske prosessen. Likestilling gjelder bare for en reversibel prosess.
forskjellen ![]() representerer arbeidvi kunne ha oppnådd, men gjorde det ikke. Det refereres til som tapt arbeid og betegnet med
representerer arbeidvi kunne ha oppnådd, men gjorde det ikke. Det refereres til som tapt arbeid og betegnet med ![]() . Med hensyn til denne mengden kan viskriv,
. Med hensyn til denne mengden kan viskriv,
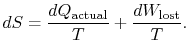 |
(6..4) |
Innholdet I Ligningen (6.4) er detentropien til et system kan endres på to måter: (i) gjennom heatexchange og (ii) gjennom irreversibilitet. Det tapte arbeidet (![]() I Ligning (6.4)) er alltid større enn null, så den eneste måten å redusere entropien av et system er gjennom varmeoverføring.
I Ligning (6.4)) er alltid større enn null, så den eneste måten å redusere entropien av et system er gjennom varmeoverføring.
for å anvende den andre loven vurderer vi total entropiendring (systemplus omgivelser). Hvis omgivelsene er et reservoar attemperatur ![]() , som systemet utveksler varme med,
, som systemet utveksler varme med,

den totale entropiendringen er
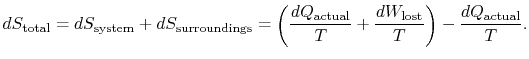
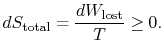
antallet (![]() ) er entropien generert på grunn av irreversibility.
) er entropien generert på grunn av irreversibility.
Enda En måte å si forskjellen vi gjør er
| (6..5) |
det tapte arbeidet kalles også dissipasjon og notert![]() . Brukdenne notasjonen, den uendelige entropiendringen av systemetblir:
. Brukdenne notasjonen, den uendelige entropiendringen av systemetblir:
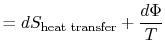 |
||
| eller | ||
Ligning (6.5) kan også skrives som arate ligning,
 |
(6..6) |
Enten Av Ligning (6.5) eller (6.6) kan tolkes til å bety at denentropi av systemet,![]() , påvirkes av to faktorer: flyten ofheat
, påvirkes av to faktorer: flyten ofheat![]() og utseendet av ekstra entropi, betegnet med
og utseendet av ekstra entropi, betegnet med![]() , på grunn av irreversibility6. 1. Denne ekstra entropien er null når prosessen er reversibel og alltid positiv når prosessen er irreversibel. Dermed kan man si at systemet utvikler segkilder som skaper entropi under en irreversibel prosess.Den andre loven hevder at vasker av entropi er umuligei naturen, noe som er en mer grafisk måte å si at
, på grunn av irreversibility6. 1. Denne ekstra entropien er null når prosessen er reversibel og alltid positiv når prosessen er irreversibel. Dermed kan man si at systemet utvikler segkilder som skaper entropi under en irreversibel prosess.Den andre loven hevder at vasker av entropi er umuligei naturen, noe som er en mer grafisk måte å si at![]() og
og![]() er positive bestemte(alltid større enn null), eller null i det spesielle tilfellet avreversible prosesser.
er positive bestemte(alltid større enn null), eller null i det spesielle tilfellet avreversible prosesser.
begrepet
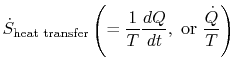
som er knyttet til varmeoverføring til systemet, kan bli tolket som en flux av entropi. Grensen krysses av varmeog forholdet mellom denne varmefluxen og temperaturen kan defineres som aflux av entropi. Det er ingen begrensninger på tegnet av dettemengde, og vi kan si at denne fluxen enten bidrar til eller drenerer bort systemets entropi. Under en reversibel prosess kan bare denne fluxen påvirke systemets entropi. Thisterminology antyder at vi tolker entropi som en slagsvektløs væske, hvis mengde er bevart (som det av materie) under en reversibel prosess. Under en irreversibel prosess, men denne væsken er ikke bevart; det kan ikke forsvinne, men heller er skapt av kilder i hele systemet. Mens dettetolkning bør ikke tas for bokstavelig, det gir aneasy uttrykksmåte og er i samme kategori av begreper som de som er knyttet til setningene «flux of energy «eller» sourcesof varme.»I væskemekanikk, for eksempel, er dette grafiske språketveldig effektiv og det bør ikke være noen innvendinger mot å kopiere det inntermodynamikk.
Gjørmete Poeng
ser vi noen gang en absolutt variabel for entropi? Så langt har vi bare jobbet med deltaer (MP 6.8)
jeg er forvirret med ![]() i motsetning til
i motsetning til ![]() .(MP 6.9)
.(MP 6.9)
for irreversible prosesser, hvordan kan vi beregne ![]() hvis ikke equalto
hvis ikke equalto ![]() ?(MP 6.10)
?(MP 6.10)
Neste: 6.6 Entropi Og Utilgjengelig Opp: 6. Anvendelser Av Forrige: 6.4 Brayton Syklus I Innhold Index
UnifiedTP