Successivo: 6.6 Entropia e non disponibile Up: 6. Applicazioni del precedente: 6.4 Ciclo di Brayton in Indice dei contenuti
Considerare un sistema a contatto con un serbatoio di calore durante un processo reversibile. Se non c’è calore ![]() assorbita da thereservoir a temperatura
assorbita da thereservoir a temperatura ![]() , la variazione di entropia del reservoiris
, la variazione di entropia del reservoiris ![]() . In generale, i processi reversibili sonoaccompagnato da scambi di calore che si verificano a diversi livelli temperatures.To analizzandoli, possiamo visualizzare una sequenza di serbatoi di calore a temperature diverse in modo che durante qualsiasi porzione infinitesimale del ciclo non ci sarà alcun calore trasferito su una differenza di temperatura finale.
. In generale, i processi reversibili sonoaccompagnato da scambi di calore che si verificano a diversi livelli temperatures.To analizzandoli, possiamo visualizzare una sequenza di serbatoi di calore a temperature diverse in modo che durante qualsiasi porzione infinitesimale del ciclo non ci sarà alcun calore trasferito su una differenza di temperatura finale.
Durante qualsiasi porzione infinitesimale, il calore ![]() saràtrasferito tra il sistema e uno dei serbatoi che si trova a
saràtrasferito tra il sistema e uno dei serbatoi che si trova a![]() Il cambio di entropia del serbatoio è
Il cambio di entropia del serbatoio è
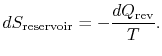
Il cambio totale di entropia del sistema e dei dintorni è
Questo vale anche se c’è una quantità di calore rifiutata dal sistema.
La conclusione è che per un processo reversibile, non si verifica alcun cambiamento nell’entropia totale prodotta, cioè l’entropia del sistema più l’entropia dell’ambiente circostante: ![]() .
.
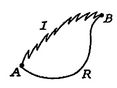
Abbiamo ora svolgere lo stesso tipo di analisi per un irreversibleprocess, che porta il sistema tra gli stessi stati specificati asin il processo reversibile. Questo è mostrato schematicamente inFigura 6.7, con ![]() Per il processo reversibile
Per il processo reversibile
Poiché il cambiamento di stato è lo stesso nei due processi (wespecified che era), il cambiamento nell’energia interna è lo stesso.Equiparando le variazioni di energia interna nei due expressionsyields precedenti
Il pedice “actual” si riferisce al processo effettivo (che èirreversible). Il cambiamento di entropia associato al cambiamento di statoè
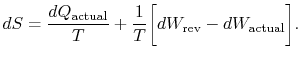 |
(6..3) |
Se il processo non è reversibile, si ottiene meno lavoro (vedi IAWnotes) che in un processo reversibile,![]() , in modo che il processo irreversibile,
, in modo che il processo irreversibile,
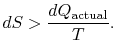
Non c’è uguaglianza tra il cambiamento di entropia![]() per un processo irreversibile. L’uguaglianza è applicabile solo per un processo reversibile.
per un processo irreversibile. L’uguaglianza è applicabile solo per un processo reversibile.
La variazione di entropia per qualsiasi processo che porta alla atransformation tra uno stato iniziale `a” e uno stato finale`b” è quindi
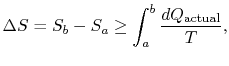
dove![]() è il calore scambiato in actualprocess. L’uguaglianza si applica solo a un processo reversibile.
è il calore scambiato in actualprocess. L’uguaglianza si applica solo a un processo reversibile.
La differenza ![]() rappresenta il lavoro che avremmo potuto ottenere, ma non l’abbiamo fatto. È indicato come lavoro perduto e indicato con
rappresenta il lavoro che avremmo potuto ottenere, ma non l’abbiamo fatto. È indicato come lavoro perduto e indicato con ![]()
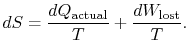
Il contenuto dell’equazione (6.4) è che l’entropia di un sistema può essere alterata in due modi: (i) attraverso lo scambio di calore e (ii) attraverso l’irreversibilità. Il lavoro perso (![]() nell’equazione (6.4)) è sempre maggiore di zero, quindi l’unico modo per diminuire l’entropia di un sistema è attraverso il trasferimento di calore.
nell’equazione (6.4)) è sempre maggiore di zero, quindi l’unico modo per diminuire l’entropia di un sistema è attraverso il trasferimento di calore.
Per applicare la seconda legge consideriamo il cambiamento totale di entropia (systemplus dintorni). Se l’ambiente circostante è un serbatoio attemperatura ![]() La variazione totale di entropia è
La variazione totale di entropia è
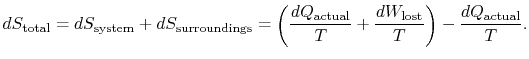
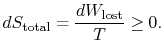
La quantità (![]() ) è l’entropia generata a causa dell’irreversibilità.
) è l’entropia generata a causa dell’irreversibilità.
Un altro modo per affermare la distinzione che stiamo facendo è
| (6..5) |
Il lavoro perso è anche chiamato dissipazione e notato![]()
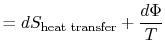
Equazione (6.5) può anche essere scritto come equazione di arate,
 |
(6..6) |
Uno dei Equazione (6.5) o(6.6) può essere interpretato nel senso che theentropy del sistema,![]() , è influenzato da due fattori: il flusso ofheat
, è influenzato da due fattori: il flusso ofheat![]() e la comparsa di ulteriori entropia, contrassegnato da
e la comparsa di ulteriori entropia, contrassegnato da![]() , a causa irreversibility6.1. Questa entropia aggiuntiva è zero quando il processo è reversibile e sempre positivo quando il processo è irreversibile. Quindi, si può dire che il sistema si sviluppafonti che creano entropia durante un processo irreversibile.La seconda legge afferma che i sink di entropia sono impossibili in natura, il che è un modo più grafico per dire che
, a causa irreversibility6.1. Questa entropia aggiuntiva è zero quando il processo è reversibile e sempre positivo quando il processo è irreversibile. Quindi, si può dire che il sistema si sviluppafonti che creano entropia durante un processo irreversibile.La seconda legge afferma che i sink di entropia sono impossibili in natura, il che è un modo più grafico per dire che![]() che è associata con trasferimento di calore al sistema, può beinterpreted come un flusso di entropia. Il confine è attraversato dal caloree il rapporto tra questo flusso di calore e la temperatura può essere definito come unlux di entropia. Non ci sono restrizioni sul segno di questoquantità, e possiamo dire che questo flusso contribuisce o drena via l’entropia del sistema. Durante un processo reversibile, solo questo flusso può influenzare l’entropia del sistema. Questominologia suggerisce di interpretare l’entropia come una sorta di fluido senza peso, la cui quantità viene conservata (come quella della materia)durante un processo reversibile. Durante un processo irreversibile, tuttavia, questo fluido non è conservato; non può scomparire, ma piuttosto è creato da fonti in tutto il sistema. Mentre questa interpretazione non dovrebbe essere presa troppo alla lettera, fornisce una modalità di espressione semplice ed è nella stessa categoria di concetti come quelli associati alle frasi “flusso di energia” o ” fonti di calore.”Nella meccanica dei fluidi, ad esempio, questo linguaggio grafico è molto efficace e non ci dovrebbero essere obiezioni a copiarlo intermodinamica.
che è associata con trasferimento di calore al sistema, può beinterpreted come un flusso di entropia. Il confine è attraversato dal caloree il rapporto tra questo flusso di calore e la temperatura può essere definito come unlux di entropia. Non ci sono restrizioni sul segno di questoquantità, e possiamo dire che questo flusso contribuisce o drena via l’entropia del sistema. Durante un processo reversibile, solo questo flusso può influenzare l’entropia del sistema. Questominologia suggerisce di interpretare l’entropia come una sorta di fluido senza peso, la cui quantità viene conservata (come quella della materia)durante un processo reversibile. Durante un processo irreversibile, tuttavia, questo fluido non è conservato; non può scomparire, ma piuttosto è creato da fonti in tutto il sistema. Mentre questa interpretazione non dovrebbe essere presa troppo alla lettera, fornisce una modalità di espressione semplice ed è nella stessa categoria di concetti come quelli associati alle frasi “flusso di energia” o ” fonti di calore.”Nella meccanica dei fluidi, ad esempio, questo linguaggio grafico è molto efficace e non ci dovrebbero essere obiezioni a copiarlo intermodinamica.
Punti fangosi
Vediamo mai una variabile assoluta per l’entropia? Finora, abbiamo lavorato solo con delta (MP 6.8)
Sono confuso su ![]() al contrario di
al contrario di![]() .(MP 6.9)
.(MP 6.9)
Per i processi irreversibili, come possiamo calcolare ![]()
![]()
![]()
![]()
![]()
Successivo: 6.6 Entropia e non disponibile Up: 6. Applicazioni del precedente: 6.4 Ciclo di Brayton in Indice dei contenuti UnifiedTP