Suivant: 6.6 Entropie et indisponible Jusqu’à: 6. Applications du précédent: 6.4 Cycle de Brayton en Indice de contenu
Considérons un système en contact avec un réservoir de chaleur pendant un processus irréversible. Si il y a de la chaleur ![]() absorbée par thereservoir à une température
absorbée par thereservoir à une température ![]() , la variation d’entropie de l’reservoiris
, la variation d’entropie de l’reservoiris ![]() . En général, les processus réversibles sontaccompagnés d’échanges de chaleur qui se produisent à différents niveaux temperatures.To analysez-les, nous pouvons visualiser une séquence de réservoirs de chaleur à différentes températures de sorte que pendant toute portion infinitésimale du cycle, il n’y aura pas de chaleur transférée sur une différence de température finale.
. En général, les processus réversibles sontaccompagnés d’échanges de chaleur qui se produisent à différents niveaux temperatures.To analysez-les, nous pouvons visualiser une séquence de réservoirs de chaleur à différentes températures de sorte que pendant toute portion infinitésimale du cycle, il n’y aura pas de chaleur transférée sur une différence de température finale.
Pendant toute portion infinitésimale, la chaleur ![]() . Si
. Si ![]() Le changement d’entropie du réservoir est
Le changement d’entropie du réservoir est
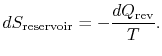
Le changement d’entropie total du système plus l’environnement est
Ceci est également vrai s’il y a une quantité de chaleur rejetée par le système.
La conclusion est que pour un processus réversible, aucun changement ne se produit dans l’entropie totale produite, c’est-à-dire l’entropie du système plus l’entropie de l’environnement: ![]() .
.
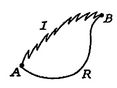
Nous effectuons maintenant le même type d’analyse pour un processus irréversible, qui prend le système entre les mêmes états spécifiés que dans le processus réversible. Ceci est représenté schématiquement en Figure 6.7, avec ![]() désignant les processus irréversibles et réversibles. Dans leur processus réversible, le système reçoit de la chaleur
désignant les processus irréversibles et réversibles. Dans leur processus réversible, le système reçoit de la chaleur ![]() et fonctionne
et fonctionne ![]() Pour le processus réversible
Pour le processus réversible
Comme le changement d’état est le même dans les deux processus (nous l’avons spécifié), le changement d’énergie interne est le même.Assimiler les changements d’énergie interne dans les deux champs d’expression ci-dessus
L’indice « réel » fait référence au processus réel (qui est irréversible). Le changement d’entropie associé au changement d’état est
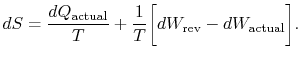 |
(6..3) |
Si le processus n’est pas réversible, on obtient moins de travail (voir les notes IAW) que dans un processus réversible, ![]() , de sorte que pour le processus irréversible,
, de sorte que pour le processus irréversible,
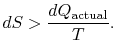
Il n’y a pas d’égalité entre le changement d’entropie ![]()
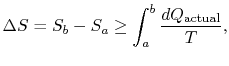
où ![]() est la chaleur échangée dans le processus réel. L’égalité ne s’applique qu’à un processus réversible.
est la chaleur échangée dans le processus réel. L’égalité ne s’applique qu’à un processus réversible.
La différence ![]() représente le travail que nous aurions pu obtenir, mais pas. Il est appelé travail perdu et désigné par
représente le travail que nous aurions pu obtenir, mais pas. Il est appelé travail perdu et désigné par ![]()
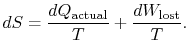
Le contenu de l’équation (6.4) est quel’entropie d’un système peut être modifiée de deux manières: (i) par échange thermique et (ii) par irréversibilité. Le travail perdu (![]() dans l’équation (6.4)) est toujours supérieur à zéro, donc le seul moyen de diminuer l’entropie d’un système est par transfert de chaleur.
dans l’équation (6.4)) est toujours supérieur à zéro, donc le seul moyen de diminuer l’entropie d’un système est par transfert de chaleur.
Pour appliquer la deuxième loi, nous considérons le changement d’entropie totale (environnement systemplus). Si l’environnement est une température de réservoir ![]() , avec laquelle le système échange de la chaleur,
, avec laquelle le système échange de la chaleur,

Le changement d’entropie total est
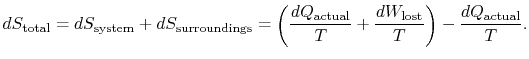
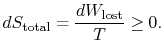
La quantité (![]() ) est l’entropie générée en raison de la réversibilité.
) est l’entropie générée en raison de la réversibilité.
Encore une autre façon d’énoncer la distinction que nous faisons est
| (6..5) |
Le travail perdu est également appelé dissipation et noté ![]() . En utilisant cette notation, le changement d’entropie infinitésimal du système devient:
. En utilisant cette notation, le changement d’entropie infinitésimal du système devient:
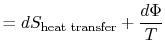 |
||
| ou | ||
Équation (6.5) peut également être écrit comme équation d’arate,
 |
(6..6) |
Soit de l’Équation (6.5) ou(6.6) peut être interprété comme signifiant que theentropy du système, ![]() , est affectée par deux facteurs: le flux ofheat
, est affectée par deux facteurs: le flux ofheat ![]() et l’apparence de l’entropie supplémentaire, désigné par
et l’apparence de l’entropie supplémentaire, désigné par![]() , en raison de irreversibility6.1. Cette entropie supplémentaire est nulle lorsque le processus est réversible et toujours positive lorsque le processus est irréversible. Ainsi, on peut dire que le système se développesources qui créent de l’entropie lors d’un processus irréversible.La deuxième loi affirme que les puits d’entropie sont impossibles dans la nature, ce qui est une façon plus graphique de dire que
, en raison de irreversibility6.1. Cette entropie supplémentaire est nulle lorsque le processus est réversible et toujours positive lorsque le processus est irréversible. Ainsi, on peut dire que le système se développesources qui créent de l’entropie lors d’un processus irréversible.La deuxième loi affirme que les puits d’entropie sont impossibles dans la nature, ce qui est une façon plus graphique de dire que ![]()
Points boueux
Voyons-nous jamais une variable absolue pour l’entropie? Jusqu’à présent, nous n’avons travaillé qu’avec des deltas (MP 6.8)
Je suis confus quant à ![]() par opposition à
par opposition à ![]() .(MP 6.9)
.(MP 6.9)
Pour les processus irréversibles, comment pouvons-nous calculer ![]()
![]()
![]()
![]()
![]()
Suivant: 6.6 Entropie et indisponible Jusqu’à: 6. Applications du précédent: 6.4 Cycle de Brayton dans l’Index des contenus UnifiedTP