další: 6.6 entropie a nedostupné Up: 6. Aplikace předchozího: 6.4 Braytonův cyklus v indexu obsahu
zvažte systém, který je v kontaktu se zásobníkem tepla během procesu přeměny. Pokud je teplo ![]() absorbovány thereservoir při teplotě
absorbovány thereservoir při teplotě ![]() , změna entropie reservoiris
, změna entropie reservoiris ![]() . Obecně platí, reverzibilní procesy areaccompanied tepelné výměny, které se vyskytují při různých teplotách.Analyzovat tyto, můžeme pozorovat sekvenci tepla nádrží atdifferent teploty tak, že při každém nekonečně malá část z cyklu nebude žádné teplo převedené přes finitetemperature rozdíl.
. Obecně platí, reverzibilní procesy areaccompanied tepelné výměny, které se vyskytují při různých teplotách.Analyzovat tyto, můžeme pozorovat sekvenci tepla nádrží atdifferent teploty tak, že při každém nekonečně malá část z cyklu nebude žádné teplo převedené přes finitetemperature rozdíl.
Během nějaké nekonečně malé části, teplo ![]() bude betransferred mezi systémem a jedním z nádrží, která je v
bude betransferred mezi systémem a jedním z nádrží, která je v![]() . Pokud
. Pokud ![]() je absorbována systém, entropychange systému je
je absorbována systém, entropychange systému je
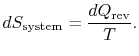
změna entropie rezervoáru je
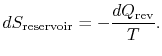
celková změna entropie systému a okolí je
to platí také v případě, že existuje množství tepla odmítnutésystém.
závěr je, že pro reverzibilní proces, žádná změna se vyskytuje v celkové entropie vyrábí, tj. entropie systému plus theentropy okolí: ![]() .
.
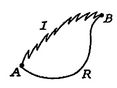
nyní Budeme provádět stejný typ analýzy pro irreversibleprocess, který bere systém mezi stejnými uvedeno státy asin reverzibilní proces. To je znázorněno schematicky v číslu 6.7, s ![]() a
a![]() označující nevratné a reverzibilní procesy. V jejich převratném procesu systém přijímá teplo
označující nevratné a reverzibilní procesy. V jejich převratném procesu systém přijímá teplo ![]() a pracuje
a pracuje![]() . Změna vnitřní energie pro proces je nevratný
. Změna vnitřní energie pro proces je nevratný
pro reverzibilní proces
Protože stát změna je stejná v obou procesů (wespecified, že to bylo), změna vnitřní energie je stejná.Srovnává změny ve vnitřní energii ve výše uvedených dvou expressionsyields
index „aktuální“ odkazuje na skutečný proces (který je převratný). Změna entropie spojená se změnou stavu
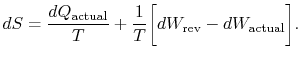 |
(6..3) |
v Případě, že proces není reverzibilní, získáme méně práce (viz IAWnotes) než v reverzibilní proces, ![]() , tak, že pro nevratný proces,
, tak, že pro nevratný proces,
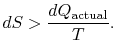
neexistuje rovnost mezi změnou entropie ![]() a kvantitou
a kvantitou ![]() pro nevratný proces. Rovnost je pouzepoužitelné pro reverzibilní proces.
pro nevratný proces. Rovnost je pouzepoužitelné pro reverzibilní proces.
změna entropie pro jakýkoli proces, který vede k atransformation mezi počáteční stav `a“ a státní závěrečnou`b“ je proto
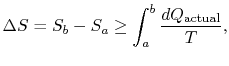
, kde ![]() je teplo vyměněné v actualprocess. Rovnost platí pouze pro reverzibilní proces.
je teplo vyměněné v actualprocess. Rovnost platí pouze pro reverzibilní proces.
rozdíl ![]() představuje workwe mohla získat, ale ne. Označuje se jako ztracená prácea označuje
představuje workwe mohla získat, ale ne. Označuje se jako ztracená prácea označuje ![]() . Pokud jde o toto množství jsme canwrite,
. Pokud jde o toto množství jsme canwrite,
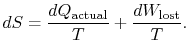 |
(6..4) |
obsah Rovnice (6.4) je, že entropie systému může být změněn dvěma způsoby: (i) prostřednictvím heatexchange a (ii) prostřednictvím irreversibilities. Ztracená práce (![]() v rovnici (6.4)) je vždy větší než nula, takže jediný způsob, jak snížit entropiisystému, je přenos tepla.
v rovnici (6.4)) je vždy větší než nula, takže jediný způsob, jak snížit entropiisystému, je přenos tepla.
pro uplatnění druhého zákona považujeme celkovou změnu entropie (systemplus okolí). Pokud je okolí nádrže attemperature ![]() , s jakou systém výměny tepla,
, s jakou systém výměny tepla,

celková změna entropie je
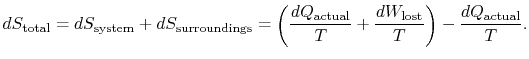
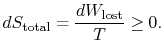
množství (![]() ) je entropie generovaná kvůlineverzibilita.
) je entropie generovaná kvůlineverzibilita.
další způsob, jak stát rozlišuje děláme je
| (6..5) |
ztracená práce se také nazývá disipace a zaznamenává se ![]() . Usingthis zápis, nekonečně malá změna entropie z systembecomes:
. Usingthis zápis, nekonečně malá změna entropie z systembecomes:
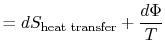 |
||
| nebo | ||
rovnice (6.5) můžeme také zapsat jako arate rovnice,
 |
(6..6) |
Buď z Rovnice (6.5) a(6.6) lze interpretovat tak, že theentropy systému, ![]() , je ovlivněn dvěma faktory: tok ofheat
, je ovlivněn dvěma faktory: tok ofheat ![]() a vzhled další entropie, označený
a vzhled další entropie, označený![]() , vzhledem k irreversibility6.1. Tato dodatečná entropie je nulová, kdyžproces je reverzibilní a vždy pozitivní, když je procesreverzibilní. Lze tedy říci, že se systém vyvíjízdroje, které vytvářejí entropii během nevratného procesu.Druhý zákon tvrdí, že klesá entropie jsou nemožná ve příroda, která je více grafické způsob, jak říct, že
, vzhledem k irreversibility6.1. Tato dodatečná entropie je nulová, kdyžproces je reverzibilní a vždy pozitivní, když je procesreverzibilní. Lze tedy říci, že se systém vyvíjízdroje, které vytvářejí entropii během nevratného procesu.Druhý zákon tvrdí, že klesá entropie jsou nemožná ve příroda, která je více grafické způsob, jak říct, že![]() a
a ![]() jsou pozitivně definitní(vždy větší než nula), nebo nula ve zvláštním případě ofreversible procesů.
jsou pozitivně definitní(vždy větší než nula), nebo nula ve zvláštním případě ofreversible procesů.
termín
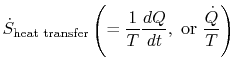
která je spojena s přenosem tepla do systému, může beinterpreted jako tok entropie. Hranice je překročena teplema poměr tohoto tepelného toku k teplotě lze definovat jako aflux entropie. Neexistují žádná omezení na znamení tohotomnožství a můžeme říci,že tento tok buď přispívá k entropii systému nebo odčerpává. Během reverzibilního procesu může pouze tento tok ovlivnit entropii systému. Thisterminologie naznačuje, že interpretujeme entropii jako druhbeztížná tekutina, jejíž množství je zachováno (jako množství hmoty)během reverzibilního procesu. Během nevratného procesu však tato tekutina není zachována; nemůže zmizet, alespíše je vytvořena zdroji v celém systému. Zatímco thisinterpretation by neměly být brány příliš doslova, poskytuje aneasy způsob vyjadřování a je ve stejné kategorii pojmů, jako jsou ty, spojené s frází `tok energie“ nebo `zdroje tepla.“Například v mechanice tekutin je tento grafický jazykvelmi efektivní a neměly by existovat žádné námitky proti jeho kopírovánítermodynamika.
blátivé body
vidíme někdy absolutní proměnnou pro entropii? Zatím jsme pracovali pouze s delty (MP 6.8)
jsem zmatený, ![]() jako protiklad k
jako protiklad k ![]() .(MP 6.9)
.(MP 6.9)
pro nevratné procesy, jak můžeme vypočítat ![]() pokud ne equalto
pokud ne equalto ![]() ?(Poslanec 6.10)
?(Poslanec 6.10)
další: 6.6 entropie a nedostupné Up: 6. Aplikace předchozího: 6.4 Braytonův cyklus v indexu obsahu
UnifiedTP