seguinte: 6.6 entropia e indisponível acima: 6. Aplicações do ciclo anterior: 6.4 Brayton no Índice de conteúdos
considere um sistema em contacto com um reservatório de calor durante o processo areversível. Se houver calor![]() absorvido pelo tereservoir à temperatura
absorvido pelo tereservoir à temperatura ![]() , a mudança na entropia dos reservoriris
, a mudança na entropia dos reservoriris ![]() . Em geral, reversíveis processos areaccompanied por trocas de calor que ocorrem em diferentes temperaturas.Para analisar estes, podemos visualizar uma sequência de reservatórios de calor atdifferent temperaturas, de modo que, durante qualquer infinitesimal parte do ciclo, não vai ser de calor transferido através de uma finitetemperature diferença.
. Em geral, reversíveis processos areaccompanied por trocas de calor que ocorrem em diferentes temperaturas.Para analisar estes, podemos visualizar uma sequência de reservatórios de calor atdifferent temperaturas, de modo que, durante qualquer infinitesimal parte do ciclo, não vai ser de calor transferido através de uma finitetemperature diferença.
Durante qualquer porção infinitesimal, calor ![]() vai betransferred entre o sistema e um dos reservatórios que está em
vai betransferred entre o sistema e um dos reservatórios que está em![]() . Se
. Se ![]() é absorvida pelo sistema, o entropychange do sistema é
é absorvida pelo sistema, o entropychange do sistema é
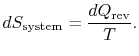
A mudança de entropia do reservatório é
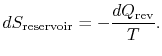
A total mudança de entropia do sistema mais perto é
isto também é verdade se houver uma quantidade de calor rejeitado pelo sistema.
a conclusão é que para um processo reversível, nenhuma mudança ocorre na entropia total produzida, ou seja, a entropia do sistema mais a entropia do ambiente: ![]() .
.
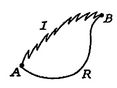
Vamos agora realizar o mesmo tipo de análise para um irreversibleprocess, o que leva o sistema entre os mesmos estados especificados asin o processo reversível. Isto é mostrado esquematicamente inFigure 6.7, com ![]() e
e![]() denotando os processos irreversíveis e reversíveis. Em seu processo reversível, o sistema recebe calor
denotando os processos irreversíveis e reversíveis. Em seu processo reversível, o sistema recebe calor ![]() e funciona
e funciona![]() . A mudança na energia interna para o processo irreversível é
. A mudança na energia interna para o processo irreversível é
para o processo reversível
porque a mudança de Estado é a mesma nos dois processos (wespecificed que era), a mudança na energia interna é a mesma.Equating the changes in internal energy in the above two expressionsyields
o subscrito `real ” refere-se ao processo real (que isirreversível). A mudança de entropia associada à mudança de Estado
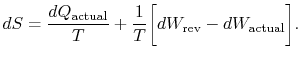 |
(6..3) |
Se o processo não é reversível, obtém-se a menos de trabalho (ver IAWnotes) do que em um processo reversível, ![]() , de modo que para o processo irreversível,
, de modo que para o processo irreversível,
A mudança na entropia para qualquer processo que leva à atransformation entre um estado inicial `a” e um estado final`b” é, portanto,
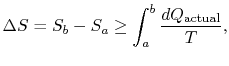
onde ![]() é o calor trocado no actualprocess. A igualdade só se aplica a um processo reversível.
é o calor trocado no actualprocess. A igualdade só se aplica a um processo reversível.
a diferença ![]() representa o trabalho que poderíamos ter obtido, mas não o fizemos. É referido como trabalho perdido e denotado por
representa o trabalho que poderíamos ter obtido, mas não o fizemos. É referido como trabalho perdido e denotado por ![]() . Em termos de esta quantidade, canwrite,
. Em termos de esta quantidade, canwrite,
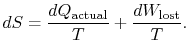 |
(6..4) |
O conteúdo da Equação (6.4) é thatthe a entropia de um sistema pode ser alterada de duas formas: (i) através de heatexchange e (ii) através de situações irreversíveis. O trabalho perdido(![]() na equação (6.4) é sempre maior que zero, então a única maneira de diminuir a entropia de um sistema é através da transferência de calor.
na equação (6.4) é sempre maior que zero, então a única maneira de diminuir a entropia de um sistema é através da transferência de calor.
para aplicar a Segunda Lei consideramos a mudança total de entropia (entorno sistemplus). Se os arredores são um reservatório attemperature ![]() , com o qual o sistema de trocas de calor,
, com o qual o sistema de trocas de calor,

a alteração total da entropia é
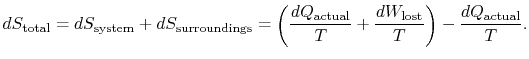
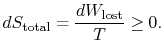
a quantidade (![]() ) é a Entropia gerada devido à sua reversibilidade.Mais uma forma de afirmar a distinção que estamos a fazer é
) é a Entropia gerada devido à sua reversibilidade.Mais uma forma de afirmar a distinção que estamos a fazer é
| (6..5) |
o trabalho perdido também é chamado dissipação e notado ![]() . Usingthis notação, o infinitesimal entropia alteração do systembecomes:
. Usingthis notação, o infinitesimal entropia alteração do systembecomes:
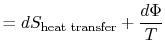 |
||
| ou | ||
equação (6.5) também pode ser escrito como arate equação,
 |
(6..6) |
Um dos Equação (6.5) ou(6.6) pode ser interpretado para significar que theentropy do sistema, ![]() , é afetado por dois fatores: o fluxo de ofheat
, é afetado por dois fatores: o fluxo de ofheat ![]() e o aparecimento de entropia adicional, denotado por
e o aparecimento de entropia adicional, denotado por![]() , devido à irreversibility6.1. Esta entropia adicional é zero quando o processo é reversível e sempre positivo quando o processo é reversível. Assim, pode-se dizer que o sistema desenvolve recursos que criam entropia durante um processo irreversível.A segunda lei afirma que os coletores de entropia são impossiblein natureza, que é um gráfico de forma de dizer que
, devido à irreversibility6.1. Esta entropia adicional é zero quando o processo é reversível e sempre positivo quando o processo é reversível. Assim, pode-se dizer que o sistema desenvolve recursos que criam entropia durante um processo irreversível.A segunda lei afirma que os coletores de entropia são impossiblein natureza, que é um gráfico de forma de dizer que![]() e
e ![]() são positivos definitiva(sempre maior do que zero, ou zero, no caso especial ofreversible processos.
são positivos definitiva(sempre maior do que zero, ou zero, no caso especial ofreversible processos.
O termo
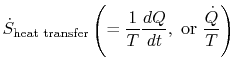
que é associado com a transferência de calor para o sistema, pode ser interpretado como um fluxo de entropia. O limite é atravessado pelo calor e a razão entre este fluxo de calor e a temperatura pode ser definida como afluxo de entropia. Não há restrições ao sinal desta quantidade,e podemos dizer que este fluxo ou contribui para, ou drena, a entropia do sistema. Durante um processo reversível, apenas este fluxo pode afetar a entropia do sistema. Thisterminology suggests that we interprete entropy as a kind of weightless fluid, whose quantity is conserved (like that of matter)during a reversible process. Durante um processo irreversível, no entanto, este fluido não é conservado; não pode desaparecer, mas é criado por fontes em todo o sistema. Embora esta interpretação não deva ser tomada demasiado literalmente, proporciona um modo de expressão fácil e está na mesma categoria de conceitos, como os associados com as frases `fluxo de energia” ou `fontes de calor”.”Na mecânica dos fluidos, por exemplo, esta linguagem gráfica é muito eficaz e não deve haver objeções a copiá-la na termodinâmica.Será Que alguma vez vemos uma variável absoluta para a Entropia? Até agora, trabalhamos apenas com deltas (MP 6.8)
I am confused as to $ dS = dq_\textrm{rev}/T$8942> as opposed to ![]() .(MP 6.9)
.(MP 6.9)
Para processos irreversíveis, como podemos calcular ![]() se não equalto
se não equalto ![]() ?(MP 6.10)
?(MP 6.10)
Seguinte: 6.6 Entropia e Disponível Até: 6. Aplicações do ciclo anterior: 6.4 Brayton no Índice de conteúdos
UnifiedTP