Weiter: 6.6 Entropie und nicht verfügbar Nach oben: 6. Anwendungen des Vorherigen: 6.4 Brayton-Zyklus im Inhaltsindex
Betrachten Sie ein System, das während eines reversiblen Prozesses mit einem Wärmespeicher in Kontakt steht. Wenn Wärme ![]() vom Reservoir bei der Temperatur
vom Reservoir bei der Temperatur ![]() absorbiert wird, ist die Änderung der Entropie des Reservoiris
absorbiert wird, ist die Änderung der Entropie des Reservoiris ![]() . Im Allgemeinen sind reversible Prozessebegleitet von Wärmeaustauschen, die bei verschiedenen auftreten temperatures.To analysieren Sie diese, Wir können eine Folge von Wärmespeichern bei unterschiedlichen Temperaturen visualisieren, so dass während eines infinitesimalen Teils des Zyklus keine Wärme über einen endlichen Temperaturunterschied übertragen wird.
. Im Allgemeinen sind reversible Prozessebegleitet von Wärmeaustauschen, die bei verschiedenen auftreten temperatures.To analysieren Sie diese, Wir können eine Folge von Wärmespeichern bei unterschiedlichen Temperaturen visualisieren, so dass während eines infinitesimalen Teils des Zyklus keine Wärme über einen endlichen Temperaturunterschied übertragen wird.
Während eines infinitesimalen Teils wird Wärme ![]() zwischen dem System und einem der Reservoirs übertragen, das sich bei
zwischen dem System und einem der Reservoirs übertragen, das sich bei![]() befindet. Wenn
befindet. Wenn ![]() vom System absorbiert wird, ist der Entropychange des Systems
vom System absorbiert wird, ist der Entropychange des Systems
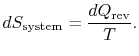
Die Entropieänderung des Reservoirs ist
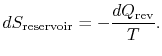
Die gesamte Entropieänderung von System plus Umgebung ist
Dies gilt auch, wenn eine Wärmemenge vom System zurückgewiesen wird.
Die Schlussfolgerung ist, dass für einen reversiblen Prozess keine Änderung der erzeugten Gesamtentropie auftritt, d. H. Der Entropie des Systems plus Derentropie der Umgebung: ![]() .
.
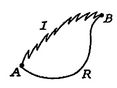
Wir führen nun dieselbe Art von Analyse für einen irreversiblen Prozess durch, der das System zwischen denselben angegebenen Zuständen wie im reversiblen Prozess führt. Dies ist schematisch in Figur 6 dargestellt.7, wobei ![]() und
und ![]() die irreversiblen und reversiblen Prozesse bezeichnen. In ihrem reversiblen Prozess empfängt das System Wärme
die irreversiblen und reversiblen Prozesse bezeichnen. In ihrem reversiblen Prozess empfängt das System Wärme ![]() und arbeitet
und arbeitet![]() . Die Änderung der inneren Energie für den irreversiblen Prozess ist
. Die Änderung der inneren Energie für den irreversiblen Prozess ist
Für den reversiblen Prozess
Da die Zustandsänderung in den beiden Prozessen gleich ist (wir angegeben, dass es war), ist die Änderung der inneren Energie gleich.Gleichsetzen der Änderungen der inneren Energie in den beiden obigen Ausdrucksfeldern
Der Index `actual“ bezieht sich auf den tatsächlichen Prozess (der irreversibel ist). Die mit der Zustandsänderung verbundene Entropieänderung ist
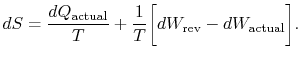 |
(6..3) |
Wenn der Prozess nicht reversibel ist, erhalten wir weniger Arbeit (siehe IAWnotes) als in einem reversiblen Prozess,![]() , so dass für den irreversiblen Prozess
, so dass für den irreversiblen Prozess
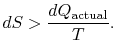
Es gibt keine Gleichheit zwischen der Entropieänderung![]() und der Menge
und der Menge![]() für einen irreversiblen Prozess. Die Gleichheit gilt nur für einen reversiblen Prozess.
für einen irreversiblen Prozess. Die Gleichheit gilt nur für einen reversiblen Prozess.
Die Änderung der Entropie für jeden Prozess, der zu einer Transformation zwischen einem Anfangszustand `a“ und einem Endzustand`b“ führt, ist daher
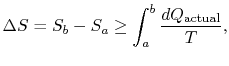
wobei![]() die im actualprozess ausgetauschte Wärme ist. Die Gleichheit gilt nur für einen reversiblen Prozess.
die im actualprozess ausgetauschte Wärme ist. Die Gleichheit gilt nur für einen reversiblen Prozess.
Die Differenz ![]() stellt Arbeit dar, die wir hätten erhalten können, aber nicht. Es wird als verlorene Arbeit bezeichnet und mit
stellt Arbeit dar, die wir hätten erhalten können, aber nicht. Es wird als verlorene Arbeit bezeichnet und mit ![]() bezeichnet. In Bezug auf diese Menge können wirschreiben,
bezeichnet. In Bezug auf diese Menge können wirschreiben,
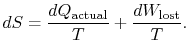 |
(6..4) |
Der Inhalt von Gleichung (6.4) ist, dassdie Entropie eines Systems auf zwei Arten verändert werden kann: (i) durch Wärmeaustausch und (ii) durch Irreversibilitäten. Die verlorene Arbeit (![]() in Gleichung (6.4)) ist immer größer als Null, so dass die Entropie eines Systems nur durch Wärmeübertragung verringert werden kann.
in Gleichung (6.4)) ist immer größer als Null, so dass die Entropie eines Systems nur durch Wärmeübertragung verringert werden kann.
Um das zweite Gesetz anzuwenden, betrachten wir die totale Entropieänderung (System + Umgebung). Wenn die Umgebung ein Reservoir attemperatur ![]() , mit dem das System Wärme austauscht,
, mit dem das System Wärme austauscht,

Die gesamte Entropieänderung ist
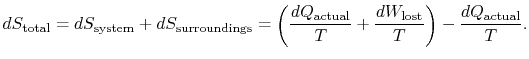
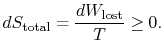
Die Menge (![]() ) ist die Entropie, die aufgrund der Irreversibilität erzeugt wird.
) ist die Entropie, die aufgrund der Irreversibilität erzeugt wird.
Noch ein anderer Weg, die Unterscheidung zu erklären, die wir machen, ist
| (6..5) |
Die verlorene Arbeit wird auch Dissipation genannt und notiert![]() . Mit dieser Notation wird die infinitesimale Entropieänderung des Systems:
. Mit dieser Notation wird die infinitesimale Entropieänderung des Systems:
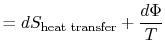 |
||
| oder | ||
Gleichung (6.5) kann auch als arate Gleichung geschrieben werden,
 |
(6..6) |
Entweder der Gleichung (6.5) oder (6.6) kann so interpretiert werden, dass Dieentropie des Systems,![]() , wird durch zwei Faktoren beeinflusst: den Wärmefluss
, wird durch zwei Faktoren beeinflusst: den Wärmefluss![]() und das Auftreten zusätzlicher Entropie, bezeichnet mit
und das Auftreten zusätzlicher Entropie, bezeichnet mit![]() , aufgrund der Irreversibilität6.1. Diese zusätzliche Entropie ist Null, wenn der Prozess reversibel ist, und immer positiv, wenn der Prozess reversibel ist. Man kann also sagen, dass sich das System entwickeltquellen, die während eines irreversiblen Prozesses Entropie erzeugen.Das zweite Gesetz behauptet, dass Entropiesenken unmöglich sindin der Natur, was eine grafischere Art ist zu sagen, dass
, aufgrund der Irreversibilität6.1. Diese zusätzliche Entropie ist Null, wenn der Prozess reversibel ist, und immer positiv, wenn der Prozess reversibel ist. Man kann also sagen, dass sich das System entwickeltquellen, die während eines irreversiblen Prozesses Entropie erzeugen.Das zweite Gesetz behauptet, dass Entropiesenken unmöglich sindin der Natur, was eine grafischere Art ist zu sagen, dass![]() und
und![]() positiv definitiv sind(immer größer als Null), oder Null im speziellen Fall vonumkehrbare Prozesse.
positiv definitiv sind(immer größer als Null), oder Null im speziellen Fall vonumkehrbare Prozesse.
Der Begriff
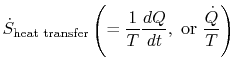
was mit der Wärmeübertragung auf das System verbunden ist, kann seininterpretiert als ein Fluss der Entropie. Die Grenze wird durch Wärme überschritten, und das Verhältnis dieses Wärmeflusses zur Temperatur kann als a definiert werdenfluss der Entropie. Es gibt keine Einschränkungen für das Vorzeichen davonmenge, und wir können sagen, dass dieser Fluss entweder zur Entropie des Systems beiträgt oder abfließt. Während eines reversiblen Prozesses kann nur dieser Fluss die Entropie des Systems beeinflussen. Diesterminologie legt nahe, dass wir Entropie als eine Art interpretierengewichtslose Flüssigkeit, deren Menge (wie die der Materie)während eines reversiblen Prozesses konserviert wird. Während eines irreversiblen Prozesses wird diese Flüssigkeit jedoch nicht konserviert, sie kann nicht verschwinden, sondern wird von Quellen im gesamten System erzeugt. Während thisinterpretation sollte nicht zu wörtlich genommen werden, es bietet aneasy Ausdrucksweise und ist in der gleichen Kategorie von Konzepten suchas diejenigen, die mit den Phrasen `Fluss der Energie“ oder `sourcesof Wärme.“ In der Strömungsmechanik zum Beispiel ist diese grafische Sprache sehr effektiv, und es sollte keine Einwände dagegen geben, sie in der Thermodynamik zu kopieren.
Schlammige Punkte
Sehen wir jemals eine absolute Variable für die Entropie? Bisher haben wir nur mit Deltas gearbeitet (MP 6.8)
Ich bin verwirrt über ![]() im Gegensatz zu
im Gegensatz zu ![]() .(MP 6.9)
.(MP 6.9)
Wie können wir für irreversible Prozesse ![]() berechnen, wenn nicht equalto
berechnen, wenn nicht equalto ![]() ?(MP 6.10)
?(MP 6.10)
Weiter: 6.6 Entropie und nicht verfügbar Nach oben: 6. Anwendungen des vorherigen: 6.4 Brayton-Zyklus im Inhaltsindex
UnifiedTP