następny: 6.6 Entropia i niedostępny Up: 6. Zastosowania poprzedniego: 6.4 cykl Braytona w indeksie zawartości
rozważmy układ stykający się ze zbiornikiem ciepła podczas procesu. Jeżeli jest ciepło![]() absorbowane przez tereservoir w temperaturze
absorbowane przez tereservoir w temperaturze ![]() , to zmiana entropii rezerwuaru
, to zmiana entropii rezerwuaru ![]() . Ogólnie rzecz biorąc, procesom odwracalnym towarzyszą wymiany ciepła, które występują w różnych temperatures.To analizując je, możemy zwizualizować sekwencję zbiorników ciepła w różnych temperaturach tak, że podczas każdej nieskończenie małej części cyklu nie będzie żadnego ciepła przenoszonego przez różnicę temperatur skończonych.
. Ogólnie rzecz biorąc, procesom odwracalnym towarzyszą wymiany ciepła, które występują w różnych temperatures.To analizując je, możemy zwizualizować sekwencję zbiorników ciepła w różnych temperaturach tak, że podczas każdej nieskończenie małej części cyklu nie będzie żadnego ciepła przenoszonego przez różnicę temperatur skończonych.
podczas każdej infinitezymalnej części, ciepło ![]() będzie mierzone pomiędzy systemem a jednym ze zbiorników, które znajduje się w
będzie mierzone pomiędzy systemem a jednym ze zbiorników, które znajduje się w![]() . Jeśli
. Jeśli ![]() jest absorbowany przez system, entropychange systemu wynosi
jest absorbowany przez system, entropychange systemu wynosi
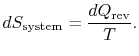
zmiana entropii zbiornika wynosi
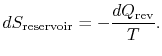
całkowita zmiana entropii systemu plus otoczenia wynosi
jest to również prawdziwe, jeśli istnieje ilość ciepła odrzucona przez system.
wniosek jest taki, że dla procesu odwracalnego nie zachodzi zmiana w wytworzonej entropii całkowitej, tj. entropii układu plus entropii otoczenia: ![]() .
.
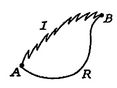
teraz przeprowadzamy ten sam rodzaj analizy dla nieodwracalnego procesu, który pobiera system między tymi samymi określonymi Stanami, co w procesie odwracalnym. Jest to pokazane schematycznie inFigure 6.7, z ![]() i
i![]() oznaczające nieodwracalne i odwracalne procesy. W procesie odwracalnym system odbiera ciepło
oznaczające nieodwracalne i odwracalne procesy. W procesie odwracalnym system odbiera ciepło ![]() i działa
i działa![]() . Zmiana energii wewnętrznej w procesie nieodwracalnym jest
. Zmiana energii wewnętrznej w procesie nieodwracalnym jest
dla procesu odwracalnego
ponieważ zmiana stanu jest taka sama w obu procesach (o ile tak było), zmiana energii wewnętrznej jest taka sama.Zrównanie zmian energii wewnętrznej w powyższych dwóch wyrażeniach
indeks dolny `actual” odnosi się do rzeczywistego procesu (który jestirreversible). Zmiana entropii związana ze zmianą stanu
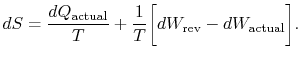 |
(6..3) |
jeśli proces nie jest odwracalny, otrzymujemy mniej pracy (patrz IAWnotes) niż w procesie odwracalnym,![]() , tak że dla procesu nieodwracalnego,
, tak że dla procesu nieodwracalnego,
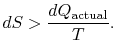
nie ma równości między zmianą entropii![]() i kwantytą
i kwantytą![]() dla nieodwracalnego procesu. Równość ma zastosowanie tylko do procesu odwracalnego.
dla nieodwracalnego procesu. Równość ma zastosowanie tylko do procesu odwracalnego.
zmiana entropii dla dowolnego procesu, która prowadzi do przekształceń między stanem początkowym ” a „a stanem końcowym” b ” jest zatem
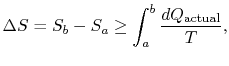
gdzie![]() to ciepło wymieniane w rzeczywistym procesie. Równość dotyczy tylko procesu odwracalnego.
to ciepło wymieniane w rzeczywistym procesie. Równość dotyczy tylko procesu odwracalnego.
różnica ![]() reprezentuje pracę, którą mogliśmy uzyskać, ale nie otrzymaliśmy. Jest on określany jako lost work I oznaczany przez
reprezentuje pracę, którą mogliśmy uzyskać, ale nie otrzymaliśmy. Jest on określany jako lost work I oznaczany przez ![]() . Pod względem tej ilości możemy,
. Pod względem tej ilości możemy,
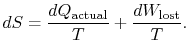 |
(6..4) |
treść równania (6.4) polega na tym, że entropia układu może być zmieniana na dwa sposoby: (i) poprzez wymianę ciepła i (ii) poprzez nieodwracalność. Utracona praca (![]() w równaniu (6.4)) jest zawsze większa od zera, więc jedynym sposobem na zmniejszenie entropii układu jest transfer ciepła.
w równaniu (6.4)) jest zawsze większa od zera, więc jedynym sposobem na zmniejszenie entropii układu jest transfer ciepła.
aby zastosować drugie prawo, rozważamy całkowitą zmianę entropii (otoczenie systemplus). Jeśli otoczenie jest zbiornikiem ![]() , z którym system wymienia ciepło,
, z którym system wymienia ciepło,

całkowita zmiana entropii wynosi
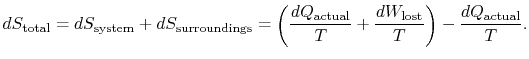
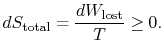
ilość (![]() ) jest entropią generowaną ze względu na ich odwracalność.
) jest entropią generowaną ze względu na ich odwracalność.
jeszcze innym sposobem na stwierdzenie rozróżnienia, które czynimy, jest
| (6..5) |
utracona praca nazywana jest również rozpraszaniem i notowana![]() . Korzystając z tej notacji, zmiana entropii infinitezymalnej układu:
. Korzystając z tej notacji, zmiana entropii infinitezymalnej układu:
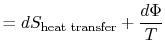 |
||
| lub | ||
równanie (6.5) można również zapisać jako równanie Arata,
 |
(6..6) |
jedno z równań (6.5) lub(6.6) można zinterpretować w ten sposób, że na entropię układu,![]() , wpływają dwa czynniki: przepływ ciepła
, wpływają dwa czynniki: przepływ ciepła![]() i pojawienie się dodatkowej entropii, oznaczonej przez
i pojawienie się dodatkowej entropii, oznaczonej przez![]() , ze względu na nieodwracalność 6.1. Ta dodatkowa Entropia jest zerowa, gdy proces jest odwracalny i zawsze dodatnia, gdy proces jest odwracalny. Można więc powiedzieć, że system rozwija źródła, które tworzą entropię podczas nieodwracalnego procesu.Drugie prawo twierdzi, że zlewki entropii są niemożliwe w naturze, co jest bardziej graficznym sposobem powiedzenia, że
, ze względu na nieodwracalność 6.1. Ta dodatkowa Entropia jest zerowa, gdy proces jest odwracalny i zawsze dodatnia, gdy proces jest odwracalny. Można więc powiedzieć, że system rozwija źródła, które tworzą entropię podczas nieodwracalnego procesu.Drugie prawo twierdzi, że zlewki entropii są niemożliwe w naturze, co jest bardziej graficznym sposobem powiedzenia, że![]() i
i![]() są dodatnio określone(zawsze większe od zera), lub zero w szczególnym przypadku procesów odwracalnych.
są dodatnio określone(zawsze większe od zera), lub zero w szczególnym przypadku procesów odwracalnych.
termin
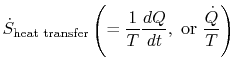
co jest związane z transferem ciepła do układu, można zinterpretować jako strumień entropii. Granica jest przekroczona przez ciepło i stosunek tego strumienia ciepła do temperatury można zdefiniować jako aflux entropii. Nie ma żadnych ograniczeń co do znaku tegoilość i możemy powiedzieć, że ten strumień przyczynia się do entropii systemu lub ją usuwa. Podczas procesu odwracalnego tylko ten strumień może wpływać na entropię układu. Teisterminologia sugeruje, że entropię interpretujemy jako rodzaj płynu bezwładnego, którego ilość jest zachowywana (podobnie jak ilość materii) podczas procesu odwracalnego. Podczas nieodwracalnego procesu płyn ten nie jest jednak konserwowany; nie może zniknąć, ale powstaje ze źródeł w całym układzie. Interpretacja ta nie powinna być traktowana zbyt dosłownie, ale zapewnia łatwy sposób wyrażania i należy do tej samej kategorii pojęć, takich jak te związane ze zwrotami „strumień energii `lub” źródła ciepła.”Na przykład w mechanice płynów ten język graficzny jest bardzo skuteczny i nie powinno być zastrzeżeń do kopiowania go w termodynamice.
czy kiedykolwiek widzimy zmienną bezwzględną dla entropii? Dotychczas graliśmy tylko z deltami (MP 6.8)
jestem zdezorientowany co do ![]() w przeciwieństwie do
w przeciwieństwie do ![]() .(MP 6.9)
.(MP 6.9)
dla procesów nieodwracalnych, jak możemy obliczyć ![]() jeśli nie equalto
jeśli nie equalto ![]() ?(MP 6.10)
?(MP 6.10)
następny: 6.6 Entropia i niedostępny Up: 6. Zastosowania poprzedniego: 6.4 cykl Braytona w spisie treści
UnifiedTP