következő: 6.6 entrópia és nem elérhető fel: 6. Az előző alkalmazások: 6.4 Brayton-ciklus a Tartalomindexben
Vegyünk egy olyan rendszert, amely hőtartállyal érintkezik az areverzibilis folyamat során. Ha van hő ![]() által elnyelt thereservoir hőmérsékleten
által elnyelt thereservoir hőmérsékleten ![]() , a változás az entrópia a tározó
, a változás az entrópia a tározó ![]() . Általában a reverzibilis folyamatokamelyet különböző hőcserék kísérnek temperatures.To elemezzük ezeket, megjeleníthetjük a hőtartályok sorozatát különböző hőmérsékleteken, így a ciklus bármely végtelen kis részében nem lesz hőátadás a véghőmérséklet-különbség felett.
. Általában a reverzibilis folyamatokamelyet különböző hőcserék kísérnek temperatures.To elemezzük ezeket, megjeleníthetjük a hőtartályok sorozatát különböző hőmérsékleteken, így a ciklus bármely végtelen kis részében nem lesz hőátadás a véghőmérséklet-különbség felett.
bármely infinitezimális rész alatt a ![]() hő átkerül a rendszer és az egyik tartály között, amely
hő átkerül a rendszer és az egyik tartály között, amely![]() . Ha
. Ha ![]() elnyeli a rendszer, a rendszer entrópiaváltozása
elnyeli a rendszer, a rendszer entrópiaváltozása
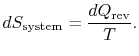
a tározó entrópiaváltozása
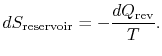
a rendszer és a környezet teljes entrópiaváltozása
ez akkor is igaz, ha a rendszer elutasítja a hőmennyiséget.
a következtetés az, hogy egy reverzibilis folyamat esetében nem történik változás a teljes előállított entrópiában, azaz a rendszer entrópiája plusz a környezet entrópiája: ![]() .
.
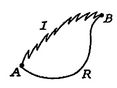
most ugyanolyan típusú elemzést hajtunk végre egy irreverzibilis folyamat esetében, amely a rendszert ugyanazon meghatározott állapotok között veszi át, mint a reverzibilis folyamatban. Ezt vázlatosan mutatjuk BE6. ábra.7, a ![]() és
és![]() a visszafordíthatatlan és reverzibilis folyamatokat jelöli. A visszafordítható folyamat során a rendszer
a visszafordíthatatlan és reverzibilis folyamatokat jelöli. A visszafordítható folyamat során a rendszer ![]() hőt kap, és
hőt kap, és![]() működik. A visszafordíthatatlan folyamat belső energiájának változása
működik. A visszafordíthatatlan folyamat belső energiájának változása
a reverzibilis folyamathoz
mivel az állapotváltozás ugyanaz a két folyamatban (mimeghatározta, hogy volt), a belső energia változása ugyanaz.A belső energia változásainak egyenlővé tétele a fenti két kifejezésmezőben
a `tényleges” alindex a tényleges folyamatra utal (ami megfordíthatatlan). Az állapotváltozáshoz kapcsolódó entrópia változása
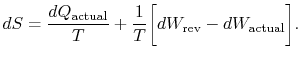 |
(6..3) |
ha a folyamat nem reverzibilis, kevesebb munkát kapunk (lásd IAWnotes), mint egy reverzibilis folyamatban,![]() , így a visszafordíthatatlan folyamathoz
, így a visszafordíthatatlan folyamathoz
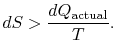
nincs egyenlőség a![]() entrópia változás és a
entrópia változás és a![]() visszafordíthatatlan folyamat között. Az egyenlőség csakreverzibilis folyamatra alkalmazható.
visszafordíthatatlan folyamat között. Az egyenlőség csakreverzibilis folyamatra alkalmazható.
az entrópia változása minden olyan folyamatra, amely az `a” kezdeti állapot és a`b ” végső állapot közötti átalakuláshoz vezet
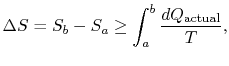
ahol![]() a tényleges folyamat során kicserélt hő. Az egyenlőség csak reverzibilis folyamatra vonatkozik.
a tényleges folyamat során kicserélt hő. Az egyenlőség csak reverzibilis folyamatra vonatkozik.
a különbség ![]() olyan munkát jelent, amelyet megszerezhettünk volna, de nem. Ez a továbbiakban Elveszett munkaés jelöli
olyan munkát jelent, amelyet megszerezhettünk volna, de nem. Ez a továbbiakban Elveszett munkaés jelöli ![]() . E mennyiség tekintetében tudunkírni,
. E mennyiség tekintetében tudunkírni,
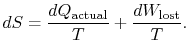 |
(6..4) |
a (6.4) egyenlet tartalma az, hogy a rendszer entrópiája kétféleképpen változtatható meg: (i) hőcsere és (ii) visszafordíthatatlanságok révén. Az elveszett munka (![]() a (6.4) egyenletben)mindig nagyobb, mint nulla, így a rendszer entrópiájának csökkentésének egyetlen módja a hőátadás.
a (6.4) egyenletben)mindig nagyobb, mint nulla, így a rendszer entrópiájának csökkentésének egyetlen módja a hőátadás.
a második törvény alkalmazásához figyelembe vesszük a teljes entrópia változást (rendszer plusz környezet). Ha a környezet egy tározó ahőmérséklet ![]() , amellyel a rendszer hőt cserél,
, amellyel a rendszer hőt cserél,

a teljes entrópia változás
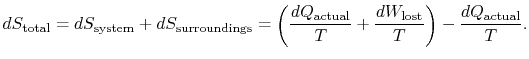
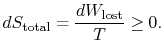
a mennyiség (![]() ) a visszafordíthatatlanság miatt generált entrópia.
) a visszafordíthatatlanság miatt generált entrópia.
még egy módja annak, hogy megállapítsuk a különbséget, amit teszünk
| (6..5) |
az elveszett munkát disszipációnak is nevezik, és![]() . Ezzel a jelöléssel a rendszer infinitezimális entrópiaváltozása válik:
. Ezzel a jelöléssel a rendszer infinitezimális entrópiaváltozása válik:
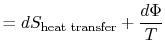 |
||
| vagy | ||
egyenlet (6.5) is lehet írni, mint arate egyenlet,
 |
(6..6) |
a (6.5) vagy a(6.6) egyenlet bármelyike úgy értelmezhető, hogy a rendszer entrópiáját,![]() , két tényező befolyásolja: a hőáramlás
, két tényező befolyásolja: a hőáramlás![]() és a további entrópia megjelenése, amelyet
és a további entrópia megjelenése, amelyet![]() jelent a visszafordíthatatlanság miatt6.1. Ez a további entrópia nulla, ha a folyamat visszafordítható, és mindig pozitív, ha a folyamat visszafordíthatatlan. Így azt mondhatjuk, hogy a rendszer fejlődikolyan források, amelyek visszafordíthatatlan folyamat során entrópiát hoznak létre.A második törvény azt állítja, hogy az entrópia süllyedései lehetetlenek a természetben, ami egy sokkal grafikusabb módja annak, hogy a
jelent a visszafordíthatatlanság miatt6.1. Ez a további entrópia nulla, ha a folyamat visszafordítható, és mindig pozitív, ha a folyamat visszafordíthatatlan. Így azt mondhatjuk, hogy a rendszer fejlődikolyan források, amelyek visszafordíthatatlan folyamat során entrópiát hoznak létre.A második törvény azt állítja, hogy az entrópia süllyedései lehetetlenek a természetben, ami egy sokkal grafikusabb módja annak, hogy a![]() és
és![]() pozitív definit(mindig nagyobb, mint nulla), vagy a visszafordítható folyamatok speciális eseteiben nulla.
pozitív definit(mindig nagyobb, mint nulla), vagy a visszafordítható folyamatok speciális eseteiben nulla.
a kifejezés
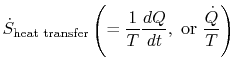
ami a rendszerbe történő hőátadáshoz kapcsolódik, az entrópia fluxusaként értelmezhető. A határt hő kereszteziés ennek a hőáramnak a hőmérséklethez viszonyított aránya az entrópia afluxusaként határozható meg. Ennek jeleire nincsenek korlátozásokés azt mondhatjuk,hogy ez a fluxus vagy hozzájárul a rendszer entrópiájához, vagy elvezet. Reverzibilis folyamat során csak ez a fluxus befolyásolhatja a rendszer entrópiáját. Ezterminológia azt sugallja, hogy az entrópiát egyfajta értelmezzüksúlytalan folyadék, amelynek mennyisége konzerválódik (mint az anyagé)egy reverzibilis folyamat során. Egy visszafordíthatatlan folyamat során azonban ez a folyadék nem konzerválódik; nem tűnhet el, deinkább az egész rendszer forrásai hozzák létre. Bár ezt az értelmezést nem szabad túl szó szerint venni, könnyű kifejezési módot biztosít, és ugyanabba a fogalomkategóriába tartozik, mint amilyenek az `energiaáram” vagy a `hőforrások ” kifejezésekhez kapcsolódnak.”Például a folyadékmechanikában ez a grafikus nyelvnagyon hatékony, és nem lehet kifogás a másolás ellentermodinamika.
sáros pontok
látunk-e valaha abszolút változót az entrópiára? Eddig csak deltákkal dolgoztunk (MP 6.8)
össze vagyok zavarodva, hogy ![]() szemben a
szemben a ![]() .(MP 6.9)
.(MP 6.9)
visszafordíthatatlan folyamatok esetén hogyan számolhatjuk ki ![]() ha nem equalto
ha nem equalto ![]() ?(MP 6.10)
?(MP 6.10)
következő: 6.6 entrópia és nem elérhető fel: 6. Az előző alkalmazások: 6.4 Brayton ciklus a Tartalomindexben
UnifiedTP