次:6.6エントロピーと利用できないアップ:6. 前のアプリケーション:6.4内容インデックス内のブレイトンサイクル
areversibleプロセス中に熱リザーバと接触しているシステムを考えてみましょう。 がある場合は熱![]() 吸収thereservoir温度
吸収thereservoir温度![]() は、エントロピーのreservoiris
は、エントロピーのreservoiris![]() . 一般に、可逆的なプロセスは、異なる場所で起こる熱交換を伴うtemperatures.To これらを分析して、サイクルの無限小部分の間に有限温度差にわたって伝達される熱がないように、異なる温度で一連の熱貯蔵所を視覚化するこ
. 一般に、可逆的なプロセスは、異なる場所で起こる熱交換を伴うtemperatures.To これらを分析して、サイクルの無限小部分の間に有限温度差にわたって伝達される熱がないように、異なる温度で一連の熱貯蔵所を視覚化するこ
任意の微小部分の間に、熱![]() は、システムと
は、システムと![]() にあるリザーバの1つとの間で裏切られます。
にあるリザーバの1つとの間で裏切られます。 ![]() がシステムに吸収された場合、システムのエントロピー変化は次のようになります。
がシステムに吸収された場合、システムのエントロピー変化は次のようになります。
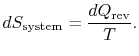
リザーバのエントロピー変化は
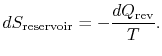
システムと周囲の総エントロピー変化は
これは、システムによって拒否された熱の量がある場合にも当てはまります。
結論は、可逆プロセスの場合、生成された総エントロピー、すなわちシステムのエントロピーに周囲のエントロピーを加えた変化は起こらないということです。![]() 。
。
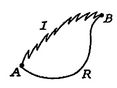
ここでは、可逆プロセスと同じ指定された状態間のシステムを取る不可逆プロセスに対して同じタイプの解析を実行します。 これは図6に概略的に示されている。図7に示すように、![]() および
および![]() は不可逆的および可逆的なプロセスを示しています。 その可逆プロセスでは、システムは熱
は不可逆的および可逆的なプロセスを示しています。 その可逆プロセスでは、システムは熱![]() を受け取り、
を受け取り、![]() を動作させます。 不可逆過程の内部エネルギーの変化は次のようになります
を動作させます。 不可逆過程の内部エネルギーの変化は次のようになります
可逆プロセス
状態変化は二つのプロセスで同じであるため(それが指定されていた)、内部エネルギーの変化は同じです。上記の二つの式における内部エネルギーの変化を等式化すると、dq_\textrm{actual}-dw_\textrm{actual}=TdS-dw_\textrm{rev}となる。Subsc添字`actual”は、実際のプロセスを指します(これは不可能です)。 状態の変化に関連するエントロピーの変化は、次のようになります。
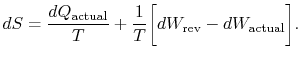 |
(6..3) |
プロセスが可逆でない場合、可逆プロセス![]() よりも少ない作業量が得られるため、不可逆プロセスでは
よりも少ない作業量が得られるため、不可逆プロセスでは
初期状態`a”と最終状態`b”との間の変換につながる任意のプロセスのエントロピーの変化は、次のようになる。
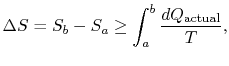
ここで、![]() は、実際のプロセスで交換される熱です。 等式は可逆プロセスにのみ適用されます。
は、実際のプロセスで交換される熱です。 等式は可逆プロセスにのみ適用されます。
の違い![]() は、私たちが得ることができた作業を表しますが、そうではありませんでした。 それは失われた仕事と呼ばれ、
は、私たちが得ることができた作業を表しますが、そうではありませんでした。 それは失われた仕事と呼ばれ、![]() で示されます。 この量の点では私達はcanwrite,
で示されます。 この量の点では私達はcanwrite,
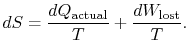 |
(6..4) |
式(6.4)の内容は、システムのエントロピーは、(i)heatexchangeと(ii)不可逆性によって二つの方法で変更することができるということです。 失われた作業(式(6.4)の![]() )は常にゼロよりも大きいので、システムのエントロピーを減少させる唯一の方法は熱伝達によるものです。
)は常にゼロよりも大きいので、システムのエントロピーを減少させる唯一の方法は熱伝達によるものです。
第二法則を適用するために、総エントロピー変化(システムプラス周囲)を考慮する。 周囲がリザーバ温度![]() の場合、システムは熱を交換します,
の場合、システムは熱を交換します,

総エントロピー変化は
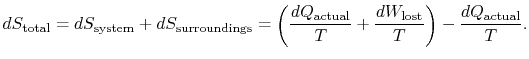
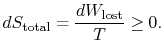
量(![]() )は、可逆性のために生成されるエントロピーです。
)は、可逆性のために生成されるエントロピーです。
私たちが作っている区別を述べるもう一つの方法は次のとおりです
| (6..5) |
失われた仕事は散逸とも呼ばれ、![]() と記されています。 この表記法を使用すると、システムの無限小エントロピー変化が得られます:
と記されています。 この表記法を使用すると、システムの無限小エントロピー変化が得られます:
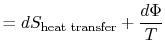 |
||
| または | ||
式(6.5)arate方程式とも書くことができます,
 |
(6..6) |
のいずれかの方程式(6.5)又は(6.6)と解釈できるという意味でtheentropyのシステム,![]() によって、二つの要因、すなわち、流ofheat
によって、二つの要因、すなわち、流ofheat![]() の外観の追加エントロピーによって示される
の外観の追加エントロピーによって示される![]() により、irreversibility6.1. この追加のエントロピーは、プロセスが可逆である場合はゼロであり、プロセスが可逆である場合は常に正です。 したがって、システムは不可逆的なプロセスの間にエントロピーを生成する源。これは、
により、irreversibility6.1. この追加のエントロピーは、プロセスが可逆である場合はゼロであり、プロセスが可逆である場合は常に正です。 したがって、システムは不可逆的なプロセスの間にエントロピーを生成する源。これは、![]() と
と![]()
泥だらけのポイント
エントロピーの絶対変数を見たことはありますか? これまでのところ、デルタのみを使用しています(MP6.私は混乱しています![]() とは対照的に
とは対照的に![]() 。不可逆的なプロセスの場合、
。不可逆的なプロセスの場合、![]() に等しくない場合、
に等しくない場合、![]() をどのように計算できますか?(エムピー-スリー)6.10)
をどのように計算できますか?(エムピー-スリー)6.10)
次:6.6エントロピーと利用できないアップ:6. 前の記事:6.4ブレイトンサイクルの目次
ユニフィードトップ